
| A. | 1L 0.1mol/L醋酸 | B. | 1L 0.1mol/L硫酸 | ||
| C. | 0.5L0.1mol/L盐酸 | D. | 2L0.1moL/L的磷酸 |
分析 电解质溶液的导电性与离子浓度成正比,与电荷成正比,电解质溶液中导电性最强,说明该溶液中离子浓度最大,据此分析解答.
解答 解:A.醋酸是弱电解质,部分电离,则溶液中氢离子浓度小于0.1mol/L;
B.硫酸是二元强酸,在水溶液中完全电离,氢离子浓度等于0.2mol/L;
C.HCl是强电解质,在水溶液中完全电离,氢离子浓度等于0.1mol/L;
D.磷酸是中强酸,部分电离,溶液中氢离子浓度小于0.2mol/L;
电解质溶液导电性与离子浓度成正比,B中氢离子浓度最大,则溶液导电性最强,故选B.
点评 本题考查电解质溶液导电性强弱判断,为高频考点,电解质溶液导电性强弱与离子浓度成正比,与溶液体积及电解质电离程度无关,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Fe2+、NO3-、HCO3- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | K+、AlO2-、Cl-、SO42- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
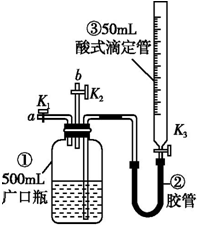 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与酸性高锰酸钾溶液反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸,敞口放置:2H++2I-+O2═I2+2H2O | |
| D. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
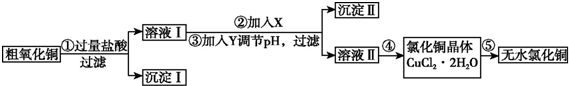
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定含有分子间作用力,但不一定含有共价键 | |
| B. | 离子晶体中一定含有离子键,但不一定含有共价键 | |
| C. | 原子晶体中一定含有共价键,硬度大,熔沸点高 | |
| D. | 原子晶体都不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com