
【题目】“五水共治”是浙江治水的成功典范,其中含氮废水处理是污水治理的一个重要课题,图3是高含氰![]() 废水处理方案:
废水处理方案:
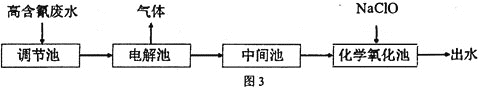
![]() 高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:
高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:![]() ,请写出第二阶段的电极反应式________。
,请写出第二阶段的电极反应式________。
![]() 电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将
电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将![]() 氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式________。
【答案】![]() 或
或![]()
![]()
【解析】
根据流程:电解高含氰(CN-)废水得到氮气等无污染的气体,电解后低含氰废水通过在碱性条件下加入NaClO,将CN-氧化为碳酸盐与对环境友好气体氮气;
(1)高含氰废水可以通过电解法进行处理,第一阶段电极反应式:CN-+2OH--2e-=CNO-+H2O,第二阶段为CNO-继续失去电子生成无污染的氮气和二氧化碳气体,据此书写;
(2)电解后低含氰废水通过在碱性条件下加入NaClO,将CN-氧化为碳酸盐与对环境友好气体氮气,ClO-自身被还原为Cl-,据此书写。
(1)第一阶段电极反应式:CN-+2OH--2e-=CNO-+H2O,第二阶段为CNO-继续失去电子生成无污染的氮气和二氧化碳气体,电极反应式为:2CNO-+4OH--6e-=2CO2↑+N2↑+2H2O(或2CNO-+8OH--6e-=2CO32-+N2↑+4H2O);
(2)电解后低含氰废水通过在碱性条件下加入NaClO,将CN-氧化为碳酸盐与对环境友好气体氮气,ClO-自身被还原为Cl-,反应为:5ClO-+2OH-+2CN-=2CO32-+N2↑+H2O+5Cl-。


科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.往等c(H+)和等体积的盐酸和醋酸中,分别加足量相同的锌片,相同状况下,与醋酸反应产生的气体体积更大
C.已知H2CO3 的 Ka1= 4.30×10-7,Ka2= 5.61×10-11,HClO的 Ka = 3.0×10-8,则反应CO2+H2O+2NaClO=Na2CO3+2HClO能够成立
D.等c(H+)的盐酸和醋酸,加水稀释100倍后,c(H+)前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
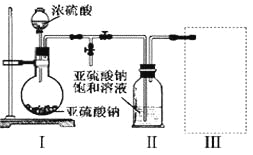
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3+ SO2= Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为_____________________________。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______________。
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填序号)。
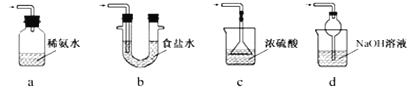
(2)(查阅资料)Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是_______________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)F-的结构示意图:__。
(2)D的气态氢化物的VSEPR模型为___,其中心原子的杂化类型为___,分子的空间构型为___。
(3)G、H和I的第一电离能数值由大到小的顺序为:___(用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有____(填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___(填分子式)。
(5)已知元素N可形成一种红紫色配合物,其组成为NCl3·5NH3·H2O。该配合物中的中心离子N离子在基态时核外简化电子排布式为___,又已知中心离子N离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是___。
(6)过去常以JE2为催化剂的载体。JE2的晶胞可作如下推导:先将NaCl晶胞中的所有Na+去掉,并将Cl-全部换成J原子,再在每两个不共面的“小立方体”中心处各放置一个J原子便构成了晶体J的一个晶胞,则一个J的晶胞中有___个J原子,再在每两个相邻的J原子(距离最近的两个J原子)中心连线的中点处增添一个E原子,便构成了JE2晶胞,故JE2晶胞中有___个E原子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。

(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,![]() 某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为
某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为![]() ;若用足量碱石灰吸收燃烧产物,则碱石灰增重
;若用足量碱石灰吸收燃烧产物,则碱石灰增重![]() 。
。
(1)计算燃烧产物中水的质量_____________。
(2)若原气体是单一气体,通过计算推断它的分子式___________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式________________(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯 是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X
是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X![]() 与另一原料Y反应制得。下列说法不正确的是( )
与另一原料Y反应制得。下列说法不正确的是( )
A.该制备反应为缩聚反应
B.Y的分子式为C15H16O2
C.传统的合成方法原料X一般选用![]() ,则合成产物中必有大量HCl气体产生
,则合成产物中必有大量HCl气体产生
D.若将原料X选为CO2,在催化剂作用下实现理论原子利用率100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如下图所示,下列判断 不 正 确的是
![]()
A.X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同
B.Y与乙酸发生取代反应生成W
C.Z和Y分子中官能团不同
D.W的分子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com