
请按要求填空。
(1)根据要求对下列物质进行分类(填序号)
A.CH3CH=CHC(CH3) B.CH2ICH=CHCH2I
C. D.HOCH2CH=CHCH2COOH
D.HOCH2CH=CHCH2COOH
属于烃的是 ;属于卤代烃的是 ;
既属于醛又属于酚的是 ;既属于醇又属于羧酸的是 .
(2)下列各组物质属于同系物的是_____,属于同分异构体的是______,属于同素异形体的是_____,属于同位素的是______,属于同一种物质的是_________。
①O2和O3 ②氕和氚 ③麦芽糖和蔗糖 ④苯和对二甲苯
⑤ 和
和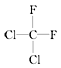 ⑥
⑥ ⑦C2H2和C4H6
⑦C2H2和C4H6
⑧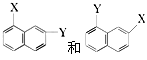 ⑨乙醇和二甲醚 ⑩淀粉和纤维素
⑨乙醇和二甲醚 ⑩淀粉和纤维素
⑾CH3CH2NO2和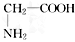 ⑿ 2-甲基-1,3-丁二烯和异戊二烯
⑿ 2-甲基-1,3-丁二烯和异戊二烯
(3)化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A 的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如下图。

则A的结构简式是_____________________________。
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.H2O分子和NH3分子具有相同数目的质子总数 B. 18O和O2-是两种不同的核素
C.H O和H
O和H O属于同素异形体 D. 14C和14N互为同位素
O属于同素异形体 D. 14C和14N互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性。回答下列问题:
| A | B | |
| C | D |
(1)A的氢化物的电子式是 。
(2)下列叙述中,正确的是 (填字母)。
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2->D2-
c.酸性:H4CO4>H2DO4 d.最高化合价:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。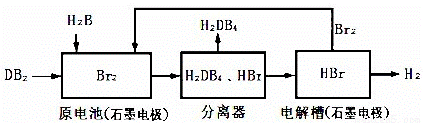
①根据资料:
| 化学式 | Ag2SO4 | AgBr | AgCl |
| Ksp | 1.4×10-5 | 5.0×10-13 | 1.8×10-10 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好。
②在原电池中,负极发生的反应式为 。
③在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”)。
④将该工艺流程用总反应的化学方程式表示为: ;该生产工艺的优点有 (答一点即可)。
⑤某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
主链为5个碳原子的C7H16的同分异构体中,其中一种同分异构体A的核磁共振氢谱有3个峰且面积比为1︰1︰6,则A的一氯代物的同分异构体的数目为( )
A.2 B.3  C.4
C.4  D.5
D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温下,一种气态烷烃和一种气态烯烃的混合物9克,其密度是相同条件下H2密度的11.25倍。当混合物通过足量的溴水时,溴水增重4.2克,则这两种气态烃是( )
A.CH4和C3H6 B.C2H6和C2H4 C.CH4和C2H4 D.CH4和C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的下列物质中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解。这种物质是( )
A.MgSO4 B.Na[Al(OH)4]
C.AlCl3 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
查阅有关资料知:金属铝与氢氧化钠溶液反应实际是分以下两步进行:
第一步:2Al+6H2O===2Al(OH)3+3H2↑
第二步:Al(OH)3+NaOH===Na[Al(OH)4]
试回答下列问题:
(1)书写金属铝与氢氧化钠溶液反应的离子方程式:____________________________。
(2)判断两步反应的反应类型:第一步属________,第二步属________(用四种基本反应类型答题)。
(3)请分析,金属铝与氢氧化钠溶液的反应中氧化剂是________,还原剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O 5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是短周期的4种元素,有关他们的信息如下表所示.
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n﹣3(n为原子核外电子层数) | 化学反应中,W原子易失去最外层电子形成与Ne原子电子层结构相同的Wn+ |
填写下列空白(提示:不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的结构式是 ,Z元素在周期表中的位置是 .
(2)X、Y、Z三元素的最高价氧化物对应的水化物酸性由强到弱的顺序是 .
(3)常温时,W的硫酸盐溶液的pH 7(填“=”“>”或“<”).理由是 (用离子方程式表示).
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是 (用离子方程式表示).
(5)W与氧化铁反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com