
| A. | ①③ | B. | ②④ | C. | ③⑥ | D. | ⑤⑥ |
分析 ①碱金属从上到下熔点降低;
②非金属性越强,氢化物越稳定;
③非金属性越强,对应单质与水反应越剧烈;
④非金属性越强,最高价氧化物的水化物酸性越强,而不能比较氢化物的酸性;
⑤非金属性越强,对应离子的还原性越弱;
⑥非金属性越强,最高价氧化物的水化物酸性越强.
解答 解:①碱金属从上到下熔点降低,而卤族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高,故错误;
②非金属性越强,气态氢化物的热稳定性越强,故错误;
③非金属性越强,对应单质与水反应越剧烈,则单质与水反应的剧烈程度:F2>Cl2>Br2>I2,故正确;
④非金属性越强,最高价氧化物的水化物酸性越强,而不能比较氢化物的酸性,故错误;
⑤非金属性S>Se,对应离子的还原性为S2-<Se2-,故错误;
⑥非金属性N>P,最高价氧化物的水化物酸性为HNO3>H3PO4,故正确;
故选C.
点评 本题考查非金属性的性质,为高频考点,把握元素的位置、性质及元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
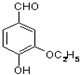 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.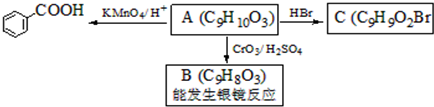
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.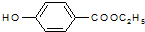 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用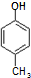 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).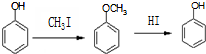
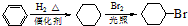
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀铜时,金属铜作阴极 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为CH3OH+6OH-+6e-═CO2+5H2O | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
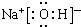 .AB-离子的电子式为
.AB-离子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
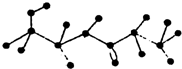 某有机物含有C、H、O、N四种元素,图为该有机物的球棍模型.
某有机物含有C、H、O、N四种元素,图为该有机物的球棍模型.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com