
组号 | 反应温度/℃ | Na2S2O3 | H2SO4 | H2O体积/mL | ||
体积/mL | 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | |||
A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
科目:高中化学 来源: 题型:阅读理解
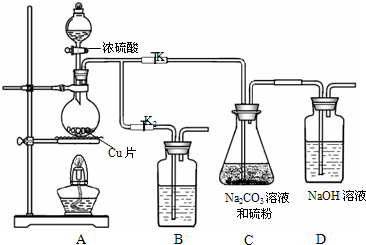
| ||
| ||
| 编 号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Na2S2O3+H2SO4=S↓+SO2+H2O+Na2SO4,通过析出硫的快慢可以说明反应速率的大小,请判断下列几种情况下,最先看到硫析出的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
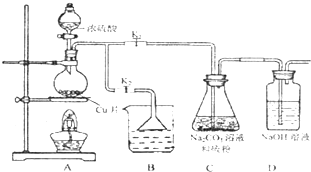 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
2- 7 |
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应温度10°,Na2S2O3体积5ml,浓度0.2/mol?L-1,H2SO4体积5ml,浓度0.1/mol?L-1,H2O体积10mL | B、反应温度10°,Na2S2O3体积5ml,浓度0.1/mol?L-1,H2SO4体积5ml,浓度0.1/mol?L-1,H2O体积10mL | C、反应温度30°,Na2S2O3体积5ml,浓度0.1/mol?L-1,H2SO4体积5ml,浓度0.1/mol?L-1,H2O体积10mL | D、反应温度30°,Na2S2O3体积5ml,浓度0.2/mol?L-1,H2SO4体积5ml,浓度0.2/mol?L-1,H2O体积10mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com