
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率[×10-3 mol?(L?min)-1] | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、乙醇与2mol?L-1的硫酸溶液混合加热到170℃制乙烯 |
| B、苯与溴水反应制取溴苯 |
| C、要鉴别己烯中是否混有少量甲苯,最恰当的实验方法是先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| D、电石与饱和食盐水作用制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
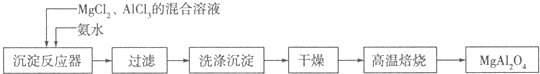

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
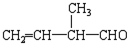 所含官能团的名称是
所含官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
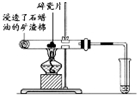 按要求完成下列问题:
按要求完成下列问题: ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| C、1 L 1mol?L-1的CH3COONa溶液中含有CH3COO-的数目为NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com