
工业上采用以石墨为电极,电解熔融的Al2O3制取金属铝,由于Al2O3的熔点很高,常加入冰晶石(Na3AlF6)做助熔剂,在1000℃左右得到熔融体.
(1)阳极反应式为________,总反应的化学方程式为________.
(2)生产1 t金属铝,转移电子的物质的量为________.
科目:高中化学 来源: 题型:阅读理解
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mo
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
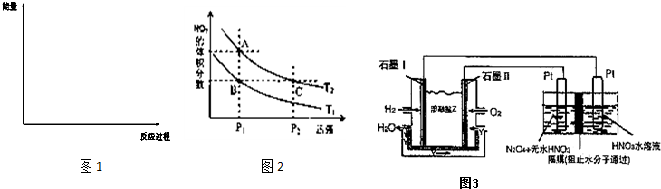
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) ![]()
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
2N2O3![]() 4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 .
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
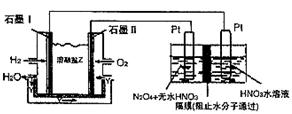
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O3的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市高三第一次模拟考试化学卷 题型:实验题
(14分)双氧水(过氧化氯)被称作“最清洁”的化学品,在纺织业和造纸业主要用作漂白剂,在化工合成中用作氧化剂和环氧化剂,在食品和医药工业中用作消毒剂、杀菌剂。目前,世界上过氧化氢的生产方法主要有电解法、葸醌法等。
I、电解法中成本最低的是过硫酸铵法
电解所用电槽以铂为阳极,以铅或石墨为阴极;NH4HSO4水溶液经阴极室,再作为阳极液从阳极室流出,得(NH4)2S2O8溶液,电解总反应式: 溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
(1)写出过氧化氢的电子式 。
(2)写出水解器中(NH4)2S2O8溶液的水解方程式 。
(3)铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
(4)试分析水解器中使用减压水解、蒸发的原因 。
Ⅱ、葸醌法是国内外大规模生产过氧化氢普遍采用的方法,生产简易流程图如下所示:

其中,触媒为催化剂,工作液为乙基葸醌与有机溶剂的混合液,主要反应方程式为:

(1)写出流程图中加“?”的操作 。
(2)写出流程图中再生使用物质的名称 。
(3)根据双氧水生产的特点,工业液中有机溶剂的选择很重要。理想的有机溶剂应满足以下要求:①对乙基葸醌和氢乙基葸醌具有良好的溶解能力:②粘度低,沸点高,难挥发,着火点高;③低毒性。请分析再写出两点要求:④ ;⑤ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com