
“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”(含有少量的Cl-、Fe3+)。某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是______(填化学式,下同)。
(2)在操作①中保持pH=8的目的是__________________________________________。
(3)沉淀Ⅰ的主要成分是____________。
(4)操作③中加热煮沸的目的是________________;此步操作的理论依据是
________________________________________________________________________。
(5)操作④保持pH=2的目的是____________;此步操作中所用的主要仪器是
________________________________________________________________________。
答案 (1)Zn(NO3)2
(2)防止生成的Zn(OH)2沉淀被溶解
(3)Zn(OH)2和Fe(OH)3
(4)促使Fe3+完全水解 温度越高,水解程度越大
(5)抑制Zn2+水解为Zn(OH)2 蒸发皿、酒精灯、铁架台、玻璃棒
解析 (1)由题意知,“烂版液”是稀硝酸腐蚀锌版后得到的“废液”,所以“烂版液”中溶质的主要成分应为Zn(NO3)2。
(2)因为Zn(OH)2具有两性,能与强碱反应,故操作①中保持pH=8的目的是为了防止生成的Zn(OH)2沉淀被溶解。
(3)碱性条件下,Fe3+、Zn2+都会转化为氢氧化物沉淀,所以沉淀Ⅰ为Zn(OH)2和Fe(OH)3。
(4)操作③是为了分离Zn(OH)2和Fe(OH)3,不难想出加热煮沸是为了促使Fe3+完全水解。
(5)通过“Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性”可知,Zn(NO3)2是一种强酸弱碱盐,易水解,故保持pH=2的目的是抑制Zn2+水解为Zn(OH)2。


科目:高中化学 来源: 题型:
(1)下列实验操作可以达到实验目的的是 (填序号,多填扣分)(2分)
A.用铝片与四氧化三铁粉末混合加热进行铝热反应。
B.向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物。
C.用酸性高锰酸钾溶液能鉴别乙烷与乙烯。
D.用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸。
E.利用燃烧的方法可以鉴别出羊毛和棉花织品。
(2)请将下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法)。(6分)
a、蒸馏 b、裂解 c、过滤 d、裂化 e、干馏 f、分馏 g、电解 h、皂化
①把煤转化为焦炉气、煤焦油和焦炭等 ;
②从原油中分离出汽油、煤油、柴油等 ;
③将重油转化为汽油 ;
④将海水淡化 ;
⑤从海水得到的无水MgCl2中制取金属镁 ;
⑥用油脂制取肥皂_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
含C、H、O三种元素的有机物A、B、D,它们的最简式相同。回答下列问题:
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,1 mol A完全燃烧生成1 mol CO2和1 mol H2O。则A的分子式为________。
(2)有机物B是日常生活中一种调味品的成分。B能和Na2CO3反应放出气体。写出B的同分异构体(能发生银镜反应)的结构简式________________________________________。
(3)有机物D的相对分子质量是A的3倍,D具有酸性,1 mol D与足量Na反应生成22.4 L H2(标准状况)。D在某种催化剂的存在下进行氧化,产物J不发生银镜反应。在浓硫酸存在下,D可发生下列反应:
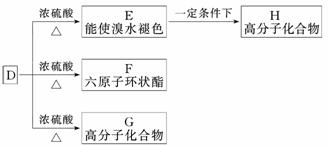
①写出D中官能团的名称:____________________________________________;
②写出J结构简式:__________________________________________________;
③E→H的化学方程式:________________________________________________
_____________________________________________________________________;
④D→F的化学方程式:_________________________________________________
______________________________________________________________________;
⑤D→G的化学方程式:_________________________________________________
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知α氨基酸与亚硝酸(HNO2)反应生成α羟基酸。如:
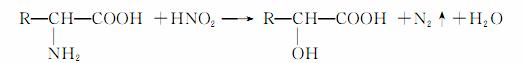 试根据下列6种有机物之间的转化关系,回答有关问题:
试根据下列6种有机物之间的转化关系,回答有关问题:
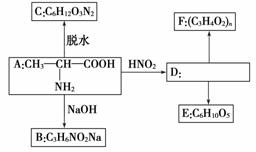
(1)写出有机物B和E的结构简式。
B:____________________,E:____________________。
(2)写出下列反应的化学方程式。
①A→C:________________________________________________________________________。
②D→F:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物M的结构简式如右图,下列说法正确的是
A.M在FeBr3 作催化剂时可与溴水发生取代反应
B.M与浓硫酸共热可发生消去反应
C.1molM发生消去反应时可消耗2molNaOH
D.M可发生消去、加成、取代、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
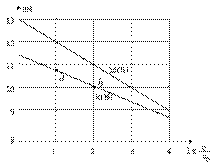 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随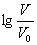 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当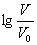 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 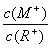 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。
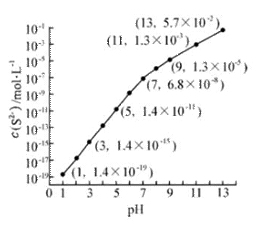
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
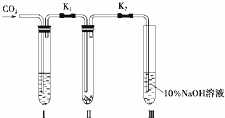
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应.在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化.
实验乙:潮湿的二氧化碳和过氧化钠的反应.在试管Ⅰ内装入试剂Y,其他操作同实验甲.观察到木条复燃,且Ⅱ中的淡黄色变为白色.
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是防止.
(2)在实验甲中,试剂X是浓硫酸;在实验乙中,试剂Y是.
(3)根据上述两个实验现象,得到的结论是.
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用(填编号).
A.大理石B.小苏打C.烧碱D.盐酸E.稀硫酸F.稀硝酸.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com