
【题目】(1)已知下列两个热化学方程式:
2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJmol-1
C3H8(g)+5O2(g) = 3CO2(g)+4H2O(l) ΔH=-2220 kJmol-1
则H2的燃烧热为_______________________,1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。
(2)一定温度下,在4L密闭容器内某一反应中气体M,气体N的物质的量随时间变化的曲线如图所示:
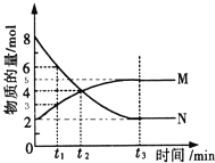
① 若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:__________________;
② t3时刻化学反应达到平衡时反应物的转化率为____________;
③ 如果升高温度则v逆 ________(填增大、减小或不变).
【答案】 △H= - 285.8kJ·mol-1 4725.8kJ 0.25mol·L-1·min-1 75% 增大
【解析】(1)常温下1mol可燃物完全燃烧生成稳定氧化物时放出的热量是燃烧热,则根据2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJmol-1,可知H2的燃烧热△H=-571.6 kJmol-1/2=-285.8kJ·mol-1;1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为285.8kJ·mol-1×1mol+2220 kJmol-1×2mol=4725.8kJ;(2)①若t2=2min,反应开始至t2时刻生成M是4mol-2mol=2mol,则M的平均化学反应速率为![]() =0.25mol·L-1·min-1;②t3时刻化学反应达到平衡时消耗N是8mol-2mol=6mol,因此反应物N的转化率为6mol/8mol×100%=75%;③升高温度正逆反应速率均增大,则v逆增大。
=0.25mol·L-1·min-1;②t3时刻化学反应达到平衡时消耗N是8mol-2mol=6mol,因此反应物N的转化率为6mol/8mol×100%=75%;③升高温度正逆反应速率均增大,则v逆增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是( )
A.每生成1 mol N2转移的电子的物质的量为6 mol
B.N2既是氧化剂,又是还原剂
C.NH4Cl中的氮元素被还原
D.NaNO2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是
A. ①②⑥ B. ②③⑥ C. ③④⑥ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 六方最密堆积的空间利用率是52%
B. 离子晶体中一定含金属阳离子
C. 在共价化合物分子中各原子都形成8电子结构
D. 分子晶体的熔点不一定比金属晶体的熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com