
| ||
| ||
| ||
| ||


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L0.1mol/L的BaCl2溶液中Cl-数为0.2NA |
| B、1mol羟基中电子数为10NA |
| C、17.6g丙烷中所含的极性共价键为4NA个 |
| D、常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:
将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:| A、容器内的压强不发生变化说明该反应达到平衡 |
| B、当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C、第12 min时改变的反应条件为升高温度 |
| D、向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
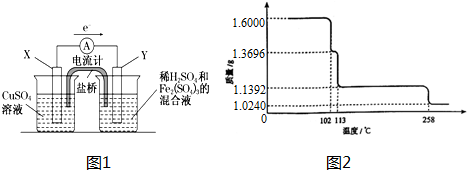
查看答案和解析>>
科目:高中化学 来源: 题型:
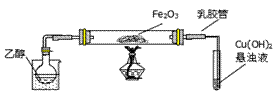 某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.30mol |
| B、0.36mol |
| C、0.42mol |
| D、0.48 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,B的转化率为80% | ||
B、平衡时,容器内压强为原来的
| ||
| C、平衡时,C的浓度为0.5mol/L | ||
| D、A的平均反应速率为0.30mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com