
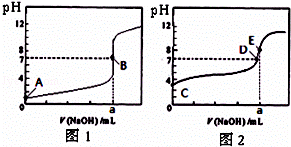
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
|
| A. | 滴定盐酸的曲线是图2 |
|
| B. | 达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A﹣) |
|
| C. | 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
|
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A﹣)>c(Na+)>c(H+)>c(OH﹣) |
考点:
酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;离子浓度大小的比较.
专题:
压轴题;电离平衡与溶液的pH专题.
分析:
A、根据盐酸和醋酸在滴定开始时的pH来判断;
B、根据溶液中的电荷守恒来判断;
C、根据酸和碱反应的化学方程式来计算回答;
D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答.
解答:
解:A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误;
B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH﹣),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A﹣),故B正确;
C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的
n(CH3COOH)=n(HCl),故C错误;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A﹣)>c(H+)>c(Na+)>c(OH﹣),故D错误.
故选B.
点评:
本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度做题.


科目:高中化学 来源: 题型:
已知醋酸溶液中有如下平衡:CH3COOH⇌CH3COO﹣+H+,下列试剂能使CH3COOH的电离程度增大且c(H+)减小的是( )
|
| A. | CH3COOH | B. | H2O | C. | CH3COONa | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为
| A.(a+b)mol | B.(a-b)mol | C.(a-b)mol | D.(a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离可达到平衡:H2O⇌H++OH﹣△H>0,下列叙述正确的是( )
|
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH﹣)降低 |
|
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
|
| C. | 向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 |
|
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
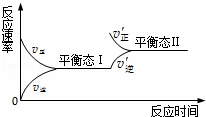
如图是恒温下某化学反应的反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( )
|
| A. | 反应达平衡时,正反应速率和逆反应速率相等 |
|
| B. | 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ |
|
| C. | 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ |
|
| D. | 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 .
(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL |
|
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.59 |
滴定中误差较大的是第 2 次实验,造成这种误差的可能原因是 .
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为 mol/L.
(5)如果准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填“是”或“否”).
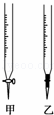
查看答案和解析>>
科目:高中化学 来源: 题型:
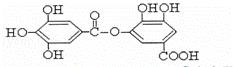
有一种有机物的结构简式如图,有关它的性质叙述,正确的是( )
①它有弱酸性,能与氢氧化钠反应;
②它不能发生水解反应;
③它能发生水解反应,水解后生成两种物质;
④它能发生水解反应,水解后只生成一种物质.
|
| A. | 只有① | B. | 只有①② | C. | 只有①③ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室利用电石与水反应制备乙炔,请写出电石主要成分碳化钙的电子式: ;写出由乙炔制备聚氯乙烯的化学方程式: ; .
(2)写出由甲苯制备TNT的化学方程式: .
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例). ; .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com