
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用碱式滴定管量取25 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)正确的操作步骤顺序中B前面是________、D后面是________(用字母填写)。
(2)滴定读数应注意:滴定管与水平的实验台面______________,并使刻度线与滴定管液面的____________相切。
(3)操作D中液面应调整到________________的某一刻度。
(4)滴定到终点时锥形瓶内溶液的pH约为_______________;终点时的颜色变化是________________。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响_______________
(6)该烧碱样品的纯度计算式是_______________________。
【答案】(1)A (1分) E (1分)
(2)保持垂直(1分) 凹面的最低处(1分)
(3)零刻度或零刻度以下(1分)
(4)3.1~4.4 (1分) 由黄变为橙色 (1分)
(5)偏高 (1分)
(6)![]() (2分)
(2分)
【解析】
试题分析:(1)正确的操作步骤顺序为 C →A→B→D→E, B前面是A ,D后面是E;(2)滴定读数应注意:滴定管与水平的实验台面保持垂直,并使刻度线与滴定管液面的凹面的最低处相切。(3)操作D中液面应调整到零刻度或零刻度以下的某一刻度;(4)甲基橙的变色范围 0-3.1红色;3.1-4.4 橙色,4.4-14
黄色,滴定到终点时锥形瓶内溶液颜色变化由黄变为橙色,所以滴定到终点时锥形瓶内溶液的pH约为3.1~4.4;(5)若酸式滴定管没有用标准H2SO4润洗,H2SO4溶液的浓度变小,消耗H2SO4溶液的体积变大,测定出的碱的浓度偏大;(6)滴定消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×cmol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2a(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:2a(V2-V1)×10-3mol×250/25=2a(V2-V1)×10-2mol;则样品中氢氧化钠的质量为m(NaOH)=nM=80a(V2-V1)×10-2g,则该烧碱样品的纯度为: [80M×(V2-V1)×10-2]/W×100%= 80M(V2-V1)/W%


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】(A类题)已知下列热化学方程式:
①CaCO3(s)=CaO+CO2(g) ΔH=+177.7 kJ
②C(s)+H2O(s)=CO(g)+H2(g) ΔH=-131.3 kJ·mol-1
③![]() H2SO4(1)+NaOH(1)=
H2SO4(1)+NaOH(1)=![]() Na2SO4(1)+H2O(1) ΔH=-57.3 kJ·mol-1
Na2SO4(1)+H2O(1) ΔH=-57.3 kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
⑤CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ·mol-1
O2(g)=CO2(g) ΔH=-283 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)=2H2O(1) ΔH=-517.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有 ,不正确的理由分别是 。
(2)根据上述信息,写出C转化为CO的热化学方程式:_______________。
(3)上述反应中,表示燃烧热的热化学方程式有 ;表示中和热的热化学方程式有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个装置,其中锌片和铜片均为足量,请回答相关问题。

(1)装置乙中可观察到的现象是_______。
(2)若甲中所用硫酸为80%的浓硫酸,开始阶段可观察到的现象是_____,锌电极上发生的反应类型是_____(填“氧化反应”或“还原反应”),此时的总反映化学方程式为_______。一段时间后装置中发生了另一个反应,原因是_______,与开始阶段相比锌片上的反应是否发生了变化______(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应为___________反应。(填“吸热”或“放热”)
(2)830℃,c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, C(H2)=0.05mol/L,该反应__________(填“是”或“否”)达到的化学平衡状态。
(3)800℃时,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01 mol/L,c(H2)=0.05 mol/L,则反应开始时,H2O的消耗速率比生成速率___________(填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为___________,H2的转化率为___________(用分数表示)。若再充入1mol H2则H2的转化率为___________(增大,减少,不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照无机物的分类方法,下列各组物质中,属于不同类型的物质是
A.纯碱、烧碱、生石灰 B.生石灰、冰、干冰
C.熟石灰、苛性钠、氢氧化钾 D.纯碱、硫酸钠、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+Y(s)=2Z(g) ,下列条件不能改变化学反应速率的是
A. 升高温度 B. 加入催化剂 C. 再加入一定量的Y D. 扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用2mL1molL-1 CuSO4 溶液和4mL0.5 molL-1 NaOH溶液混合,然后加入40%的甲醛溶液0.5mL,加热到沸腾,未见红色沉淀产生,主要原因是( )
A. 甲醛的量太少 B. CuSO4 的量太少 C. NaOH的量太少 D. 加热时间太短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质 | A | B | C |
初始浓度/mol·L-1 | 1.0 | 2.0 | 0 |
2min时,平衡浓度/mol·L-1 | 0.4 | 0.2 | 1.2 |
请填写下列空白:
(1)该反应方程式可表示为: ;反应达平衡时,A的转化率为___________。
(2)从反应开始到达化学平衡,生成C的平均反应速率为 ;25℃时,反应的化学平衡常数K值(数值)为_____________。
(3)能判断该反应已达到化学平衡状态的依据是__________。
a.容器内压强不变
b.混合气体的密度不变
c.3v正(B)=2v逆(C)
d.c(A)=c(C)
e.混合气体的平均相对分子质量不变
(4)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:
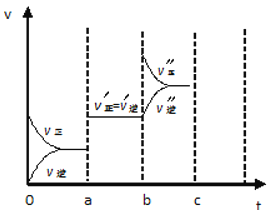
a 点时改变的条件可能是 ;b点时改变的条件可能是 。
(5)如果上述反应起始是按“1 mol A+3 mol B”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号)
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com