
| A. | S的燃烧热为297KJ/mol | |
| B. | 1mol硫蒸气完全燃烧放出的热量大于297KJ | |
| C. | 1mol硫蒸气完全燃烧放出的热量小于297KJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
分析 由S(s)+O2(g)═SO2(g)△H=-297kJ/mol,可知该反应为放热反应,S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,以此来解答.
解答 解:A.由S(s)+O2(g)═SO2(g)△H=-297kJ/mol,可知S的燃烧热为297KJ/mol,故A正确;
B.S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则1mol硫蒸气完全燃烧放出的热量大于297 kJ,故B正确;
C.S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则1mol硫蒸气完全燃烧放出的热量大于297 kJ,故C错误;
D.该反应为放热反应,则形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量,故D正确;
故选C.
点评 本题考查燃烧热的热化学反应方程式,明确燃烧的概念及反应热与键能、盖斯定律的关系即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
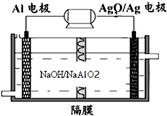 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
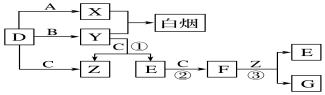
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制金属钠 | B. | 电解熔融氯化镁制金属镁 | ||
| C. | 氧化铁与一氧化碳高温反应炼铁 | D. | 焦炭高温还原二氧化硅制粗硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | SO32- | C. | S | D. | S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com