
| A. | 面心立方最密堆积 | B. | 体心立方最密堆积 | ||
| C. | 六方最密堆积 | D. | 简单立方堆积 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 水电离出的OH-浓度:10c(OH-)A>c(OH-)B | |
| B. | 溶液的体积:10VA≤VB | |
| C. | 若分别用等浓度的氢氧化钠溶液完全中和,所得溶液的pH:A>B | |
| D. | 若分别与10mLpH=12的氢氧化钠溶液反应,所得溶液的pH:A≤B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ca(OH)2=Ca2++2(OH)- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性KMnO4溶液中通入SO2气体后紫红色消失 | |
| B. | 滴有酚酞的NaOH溶液中通入SO2气体后红色消失 | |
| C. | 品红溶液中通入SO2气体后红色消失 | |
| D. | 溴水中通入SO2气体后橙色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (X+Y+n)g | B. | (X+Y-n)g | C. | (X+Y-n)/NA g | D. | (X+Y+n)/NAg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA | |
| C. | 标准状况下,B2H6(g)和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 在浓硫酸作用下,60g冰醋酸与足量无水乙醇反应生成乙酸乙酯的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
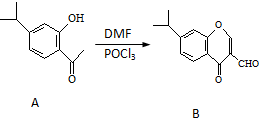 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中至少有8个碳原子位于同一平面 | |
| B. | 1molA与浓溴水发生取代反应时,最多消耗3molBr2 | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与6mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com