
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
分析 A、求出乙烯的物质的量,然后根据1mol乙烯中含2mol碳原子来分析;
B、铵根离子和氢氧根均为10电子微粒;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
解答 解:A、14g乙烯的物质的量为0.5mol,而1mol乙烯中含2mol碳原子,故0.5mol乙烯中含1mol碳原子即NA个,故A正确;
B、铵根离子和氢氧根均为10电子微粒,故1mol铵根离子和1mol氢氧根中均含10mol电子即10NA个,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L甲烷的物质的量小于1mol,则含有的C-H键的个数小于4NA个,故C错误;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下CH4是液体 | B. | 一氯甲烷分子式为CH4Cl | ||
| C. | CH4与Cl2可以发生加成反应 | D. | CH4完全燃烧生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
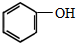 (制酚醛树脂)
(制酚醛树脂) 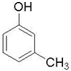 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2CO3+H2SO4═(NH4)2SO4+H2O+CO2↑ | |
| B. | NaHCO3+HNO3═NaNO3+H2O+CO2↑ | |
| C. | Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑ | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
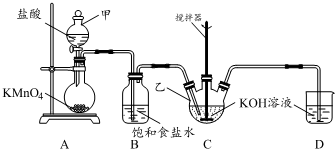 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
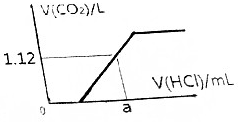 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com