
| A、溴乙烷中滴入硝酸银溶液检验其中的溴元素:Ag++Br-=AgBr↓ | ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1 | ||||
C、用惰性电极电解饱和KCl溶液:2 H++2 Cl-
| ||||
| D、硫酸亚铁与双氧水、稀H2SO4混合:2 Fe2++H2O2+2 H+=2 Fe3++2 H2O |
| ||


科目:高中化学 来源: 题型:
| A、② | B、③ | C、①和④ | D、②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNaOH的质量为40g?mol-1 |
| B、标准状况下,1molH2O2的体积为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH-=HSO3-+CO32-+H2O |
| B、向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| C、向Fe(NO3)3溶液中加入过量的HI溶液 2NO3-+8H++6I-=3I2+2NO↑+4H2O |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲醛的电子式: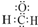 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
| ||
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱式碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com