
【题目】下列关于物质分类的说法不正确的是
A. 金刚石、红磷都属于单质 B. 漂白粉、玻璃都属于混合物
C. 氯化铵、氨气都属于电解质 D. 生铁、青铜都属于合金
科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过一步化学反应完成的是
A.CO2→H2CO3B.SiO2→H2SiO3 C.Na2O2→Na2CO3D.SiO2→Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH—O共价键放出463kJ的热量。反应2H2(g)+O2(g)=2H2O(g)的能量变化如右图所示。下列说法正确的是

A. 2H(g)→H2(g) ![]() H >0
H >0
B. 图中E1 = 932kJ
C. 图中E2 = 926 kJ
D. 2H2(g)+O2(g)=2H2O(g) ![]() H =-484 kJ·mol-1
H =-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末
A. ①②③ B. ①②④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组同学用下图所示的装置来制备溴苯并探究其反应类型。
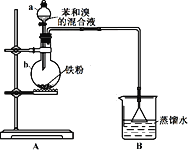
(1)仪器a名称为_________。B装置的作用是__________________。
(2)打开a的活塞将苯和溴的混合液滴入b中,反应立即开始。写出b中发生有机反应的化学方程式______________________。
(3)实验开始后,首先观察到b中液体沸腾,且装置内充满红棕色气体。然后观察到B中倒扣的漏斗内现象是__________________,说明b中反应有HBr生成,证明制备溴苯的反应是取代反应。
(4)甲同学向B装置的烧杯中滴入几滴AgNO3溶液,观察到_________________,据此进一步确证有HBr生成。乙同学认为甲同学的判断并不准确,则可能的理由是___________。如果要排除干扰,可在A、B之间增加一个洗气瓶,内装试剂可以是__________________(选填序号)。
①NaOH溶液 ②饱和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图所示,主要步骤如下(并非正确顺序):
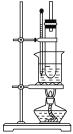
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中。
b.在50~60 ℃下发生反应,直至反应结束。
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
回答下列问题:
①步骤b中的加热方法为__________,其优点是_________________________________________。
②粗产品用5%NaOH溶液洗涤的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。

(1)阴影部分元素N在元素周期表中的位置为_____。根据元素周期律,预测酸性强弱:H3AsO4______H3PO4(填“>”或“<”)。
(2)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的程度比S与H2反应程度___(填“更大”“更小”或“相同”)。
(3)下列说法错误的是______(填序号)。
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③干冰升华、液态水转变为气态水都要克服分子内的共价键
④HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)

请回答下列问题:
(1)仪器1的名称是__________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________(填序号);目的是______________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________(填“A”或“B”,下同),打开阀门___________________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.024g,则该实验所得产品的产率为__________(不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________,再加入碱液,调节pH至少为________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31,![]() =4,lg2≈0.3)
=4,lg2≈0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某烷烃与烯烃的混合气体9.00g,该混合气体的密度为相同状况下氢气的11.25倍,将混合气体通过足量溴水,溴水质量增加4.20g,则原混合气体的组成为( )
A. 甲烷 、乙烯B. 乙烷 、乙烯C. 甲烷 、丙烯D. 甲烷 、丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com