
[化学——选修5:有机化学基础]
Ⅰ.水杨酸的结构简式为 ,
,
(1)下列关于水杨酸的叙述正确的是_______________。
A. 与
与 互为同系物
互为同系物
B.水杨酸分子中所有原子一定都在同一平面上
C.水杨酸既可以看成是酚类物质,也可以看成是羧酸类物质
(2)将水杨酸与______________溶液作用,可以生成 ;请写出将
;请写出将 转化为
转化为 的化学方程式_______________。
的化学方程式_______________。
Ⅱ.用质谱法分析得知某链状烯烃的相对分子质量为124。用酸性KMnO4溶液氧化,得到两种产物:a.CH3COOH, b.
R1-CH=CH-R2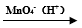 R1-COOH + R2-COOH
R1-COOH + R2-COOH
(3)a的名称为________________。
(4)写出该烃可能的结构简式___________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年安徽省高一上期中化学卷(解析版) 题型:选择题
下列物质的性质描述正确的是
A.Fe在Cl2中燃烧生成FeCl2和FeCl3
B.Na2O2与H2O反应中,Na2O2只作氧化剂
C.FeCl3溶液能与Cu反应,可用蚀刻印刷电路
D.汽车尾气中CO与NO反应生成NO2和CO2
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
如图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是
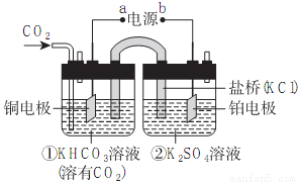
A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,② 池中溶液的pH不一定升高
池中溶液的pH不一定升高
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。
A. ①②④⑤ B. ①②③⑥ C. ①③⑤⑥ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA
B.常温下 ,100 mL 1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
,100 mL 1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
C.将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
D.1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上月考三化学试卷(解析版) 题型:选择题
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
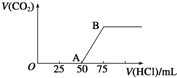
A.OA段所发生反应的离子方程式:H++OH﹣═H2O;CO32﹣+H+═HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考四化学卷(解析版) 题型:填空题
煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)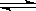 CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)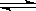 CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
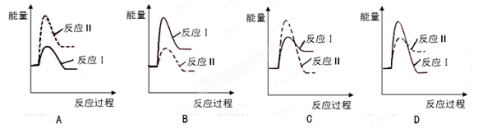
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
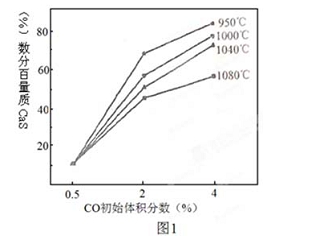
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高一上期中化学卷(解析版) 题型:选择题
关于同温、同压下等质量的SO2气体和CO2气体,下 列比较正确
列比较正确 的是 ( )
的是 ( )
①密度比为16∶11 ②密度比为11∶16 ③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上11月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.金属单质在反应中只能做还原剂,非金属单质只能做氧化剂
B.某元素从化合态到游离态,该元素一定被还原
C.失电子多的金属还原性强
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com