£Ø2012?ŌĄŃō¶žÄ££©ČēĶ¼ŹĒŗĻ³É°±ŗĶĄūÓĆ°±ÖĘČ”ĻõĖį”¢“æ¼īµÄ¼ņŅŖĮ÷³ĢŹ¾ŅāĶ¼£ŗ
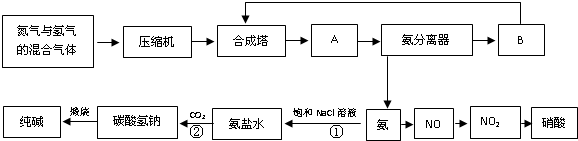
£Ø1£©Éč±øAµÄĆū³ĘŹĒ
ĄäÄżĘ÷
ĄäÄżĘ÷
£¬Éč±øBµÄĆū³ĘŹĒ
Ń»·Ń¹Ėõ»ś
Ń»·Ń¹Ėõ»ś
£®
£Ø2£©ÓŠ¹ŲŗĻ³É°±¹¤ŅµµÄĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ
B
B
£®
A£®“ÓŗĻ³ÉĖž³öĄ“µÄ»ģŗĻĘųĢ壬ĘäÖŠNH
3Ö»Õ¼15%£¬ĖłŅŌÉś²ś°±µÄ¹¤³§µÄŠ§ĀŹ¶¼ŗܵĶ
B£®ÓÉÓŚ°±Ņ×Ņŗ»Æ£¬N
2ӢH
2ŹĒŃ»·Ź¹ÓĆ£¬ĖłŅŌ×ÜĢåĄ“Ėµ°±µÄ²śĀŹŗÜøß
C£®ŗĻ³É°±¹¤ŅµµÄ·“Ó¦ĪĀ¶ČæŲÖĘŌŚ500”ę×óÓŅ£¬ÄæµÄŹĒŹ¹»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ
D£®ŗĻ³É°±³§²ÉÓƵÄŃ¹ĒæŹĒ2”Į10
7”«5”Į10
7Pa£¬ŅņŌŚøĆŃ¹ĒæĻĀĢś“„Ć½µÄ»īŠŌ×ī“ó
£Ø3£©ŌŚ“æ¼īÖĘŌģ¹ż³ĢÖŠ£¬¹ż³Ģ¢ŁÓė¹ż³Ģ¢ŚµÄĖ³ŠņÄÜ·ńµßµ¹£æ
²»ÄÜ
²»ÄÜ
£¬ĘäĄķÓÉŹĒ
ŅņĪŖCO2ŌŚĖ®ÖŠČܽā¶Č½ĻŠ”£¬Ė³Šņµßµ¹ŗóµĆ²»µ½½ĻøßÅØ¶ČµÄHCO3-£¬ĖłŅŌƻӊNaHCO3Éś³É
ŅņĪŖCO2ŌŚĖ®ÖŠČܽā¶Č½ĻŠ”£¬Ė³Šņµßµ¹ŗóµĆ²»µ½½ĻøßÅØ¶ČµÄHCO3-£¬ĖłŅŌƻӊNaHCO3Éś³É
£®Čō²śĘ·“æ¼īÖŠŗ¬ÓŠĢ¼ĖįĒāÄĘ£¬ÓĆ¼ÓČČ·Ö½āµÄ·½·Ø²ā¶Ø“æ¼īÖŠĢ¼ĖįĒāÄʵÄÖŹĮæ·ÖŹż£¬“æ¼īÖŠĢ¼ĖįĒāÄʵÄÖŹĮæ·ÖŹżæɱķŹ¾ĪŖ£ŗ
£Ø×¢Ć÷ÄćµÄ±ķ“ļŹ½ÖŠĖłÓƵÄÓŠ¹Ų·ūŗŵÄŗ¬Ņ壩
£Ø4£©ĻõĖį³§µÄĪ²ĘųÖŠŗ¬ÓŠNOŗĶNO
2µČĪŪČ¾Īļ£¬³£ĄūÓĆø÷ÖÖČ¼ĮĻĘųÖŠµÄ¼×ĶéµČ½«µŖµÄŃõ»ÆĪļ»¹ŌĪŖæÕĘųÖ÷ŅŖ³É·Ö¶ų³żČ„£®Š“³ö¼×ĶéÓėNO
2·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½£ŗ
CH4+2NO2ØTN2+CO2+2H2O
CH4+2NO2ØTN2+CO2+2H2O
£®
Čō»łÓŚĻĀĮŠ·“Ó¦µÄ·½·ØÖĪĄķ£ŗ2NO
2+2NaOH”śNaNO
3+NaNO
2+H
2O£¬NO+NO
2+2NaOH”ś2NaNO
2+H
2O£»ĻÖÓŠ±ź×¼×“æöĻĀNO”¢NO
2µÄ»ģŗĻĪļĒ”ŗĆÓė50mL 2.0mol?L
-1µÄNaOHČÜŅŗ·“Ó¦ĶźČ«£¬ĒŅÉś³ÉNaNO
2ŗĶNaNO
3µÄĪļÖŹµÄĮæµÄ±ČÖµĪŖ4£ŗ1£¬ŌņŌŚ»ģŗĻĘųĢåÖŠNOĘųĢåµÄĢå»ż·ÖŹżĪŖ
0.3
0.3
£®



 ½šÅĘ½ĢøØÅąÓÅÓÅŃ”¾ķĘŚÄ©³å“Ģ100·ÖĻµĮŠ“š°ø
½šÅĘ½ĢøØÅąÓÅÓÅŃ”¾ķĘŚÄ©³å“Ģ100·ÖĻµĮŠ“š°ø

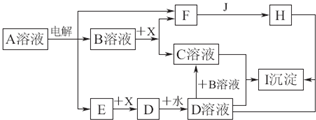
 A”¢B”¢D”¢E”¢GĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®AŌŖĖŲŌŚÖÜĘŚ±ķÖŠŌ×Ó°ė¾¶×īŠ”£¬BŌŖĖŲµÄ×īøßÕż»ÆŗĻ¼ŪŗĶ×īµĶøŗ»ÆŗĻ¼ŪµÄ¾ų¶ŌÖµĻąµČ£¬EŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµÄ3±¶£®EŗĶGæÉŠĪ³ÉĄė×Ó»ÆŗĻĪļGE£®
A”¢B”¢D”¢E”¢GĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®AŌŖĖŲŌŚÖÜĘŚ±ķÖŠŌ×Ó°ė¾¶×īŠ”£¬BŌŖĖŲµÄ×īøßÕż»ÆŗĻ¼ŪŗĶ×īµĶøŗ»ÆŗĻ¼ŪµÄ¾ų¶ŌÖµĻąµČ£¬EŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµÄ3±¶£®EŗĶGæÉŠĪ³ÉĄė×Ó»ÆŗĻĪļGE£®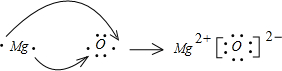
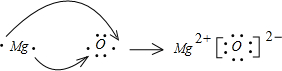
 ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬ČŻĘ÷ÄŚÄ³Ņ»·“Ó¦ÖŠM”¢NµÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼ä±ä»ÆµÄĒśĻßČēĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬ČŻĘ÷ÄŚÄ³Ņ»·“Ó¦ÖŠM”¢NµÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼ä±ä»ÆµÄĒśĻßČēĶ¼£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©