
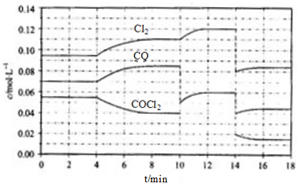
 COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):分析 (1)由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式K=$\frac{c(CO)×c(C{l}_{2})}{c(COC{l}_{2})}$计算;
(2)第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,结合温度对平衡影响判断;
(3)4min~10min内COCl2的浓度减少量为(0.055-0.04)mol/L=0.015mol/L,再计算转化COCl2的物质的量,结合热化学方程式计算吸收的热量;
(4)由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
(5)10min瞬间,CO的浓度减小,二氧化碳浓度不变,而后平衡正向移动,不能是改变温度,应是移走CO,14min到达平衡.在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答 解:(1)由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=$\frac{c(CO)×c(C{l}_{2})}{c(COC{l}_{2})}$=$\frac{0.085×0.11}{0.04}$=0.234mol/L,故答案为:0.234mol/L;
(2)由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),故答案为:<;
(3)4min~10min内COCl2的浓度减少量为(0.055-0.04)mol/L=0.015mol/L,转化COCl2的物质的量为0.015mol/L×20L=0.3mol,吸收的热量为0.3mol×108kJ•mol-1=32.4kJ,即外界至少需要提供23.4kJ能力,故答案为:32.4kJ;
(4)由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:$\frac{0.06×0.12}{c(COC{l}_{2})}$=0.234mol/L,解得c(COCl2)=0.031mol/L,
故答案为:0.031;
(5)10min瞬间,CO的浓度减小,二氧化碳浓度不变,而后平衡正向移动,不能是改变温度,应是移走CO,14min到达平衡,在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
点评 本题考查化学平衡计算、化学平衡移动、平衡常数、浓度随时间变化曲线等,理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | B. | 2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
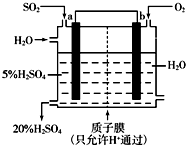 在硫酸工业中,SO2转化为SO3是一个关键步骤
在硫酸工业中,SO2转化为SO3是一个关键步骤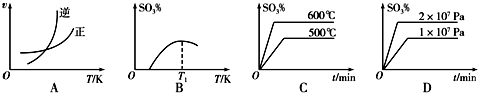
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
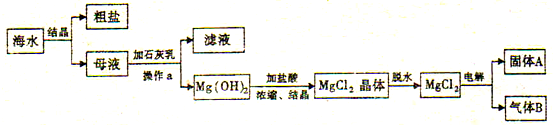
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com