
| A、T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-6NA |
| B、12.0gNaHSO4固体中含有的阳离子数目为0.1NA |
| C、50g98%的浓硫酸中,所含的氧原子数目为2NA |
| D、1molNa2O2与足量CO2充分反应转移的电子数目为NA |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、1mol任何气体的体积都约是22.4 L |
| B、常温下,28 g氮气所含的原子数目为NA |
| C、在标准状况下,1mol任何物质所占的体积都约为22.4 L?mol-1 |
| D、醋酸的摩尔质量(单位为g?mol-1)与NA个醋酸分子的质量(单位为g)在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| B、铝与氢氧溶液化钠反应 Al+2OH-=AlO2-+H2↑ |
| C、向Na2CO3浓溶液中缓慢滴加几滴稀盐酸 CO32-+H+=HCO3- |
| D、用氯化铁溶液腐蚀电路板上多余的铜 Cu+Fe3+=Cu2++Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500 mL,106g |
| B、950 mL,201.4g |
| C、任意规格,201.4g |
| D、1000 mL,212g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 某溶液先通入少量Cl2后,再加入淀粉溶液 | 溶液变蓝 | 该溶液中一定含有I- |
| B | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 将SO2通入酸性KMnO4溶液中 | 酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 过量的Fe粉中加入HNO3充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Fe2+、SO42-、Br- |
| B、Na+、Al(OH)4-、Cl-、SO42- |
| C、Mg2+、Ca2+、HCO3-、Cl- |
| D、Fe2+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在298 K时,11.2 L H2完全燃烧生成液态水放出的热量为142.9 kJ | ||
| B、H2(g)的燃烧热是285.8 kJ,则2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
| C、在298 K时,2H2(g)+O2(g)═2H2O(g)△H<-571.6 kJ?mol-1 | ||
D、H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
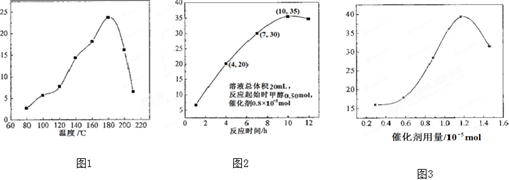
查看答案和解析>>
科目:高中化学 来源: 题型:
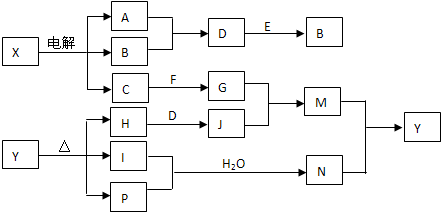
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com