
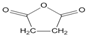
 ),试剂③是环氧乙烷(
),试剂③是环氧乙烷(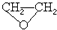 ),且环氧乙烷在酸或碱中易水解或聚合.
),且环氧乙烷在酸或碱中易水解或聚合.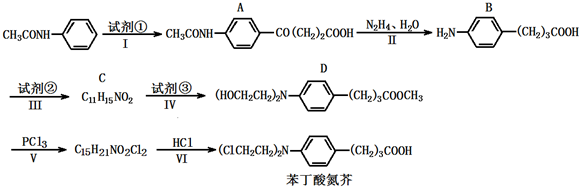
 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$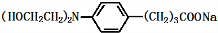 +2NaCl+H2O
+2NaCl+H2O分析 (1)对比A、B的结构简式可知,A中肽键转化为氨基,羰基转化为亚甲基,属于还原反应;对比D与苯丁酸氮芥的结构可知,反应V为取代反应,而反应VI为酯的水解反应;
(2)试剂③是环氧乙烷,对比B、D的结构简式,反应Ⅲ是B与甲醇发生酯化反应;
(3)将羧酸转化成酯,防止环氧乙烷水解或聚合;
(4)D的一种同分异构体G有下列性质:①属于芳香族化合物,且苯环上的一氯取代物只有一种,②能与盐酸反应成盐,不能与碳酸氢钠溶液反应,说明含有氨基,不含羧基,③能发生水解反应和银镜反应,说明含有酯基、醛基,④0.1摩尔G与足量金属钠反应可放出标况下2.24升氢气,含有2个羟基;
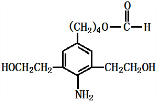
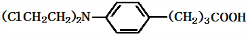
(5)苯丁酸氮芥中Cl原子、羧基均与足量氢氧化钠反应;
(6)1,4-丁烯二醇与HCl发生加成反应,再发生催化氧化,然后会发生水解反应、酸化得到HOOC-CH=CH-COOH,最后与氢气发生加成反应得到HOOCCH2CH2COOH.
解答 解:(1)对比A、B的结构简式可知,A中肽键转化为氨基,羰基转化为亚甲基,属于还原反应;对比D与苯丁酸氮芥的结构可知,反应V为取代反应,而反应VI为酯的水解反应,
故答案为:还原反应;取代反应;
(2)试剂③是环氧乙烷,对比B、D的结构简式,反应Ⅲ是B与甲醇发生酯化反应,故C的结构简式为: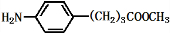 ,
,
故答案为: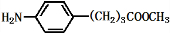 ;
;
(3)设计反应Ⅲ的目的是:将羧酸转化成酯,防止环氧乙烷水解或聚合,
故答案为:将羧酸转化成酯,防止环氧乙烷水解或聚合;
(4)D的一种同分异构体G有下列性质:①属于芳香族化合物,且苯环上的一氯取代物只有一种,②能与盐酸反应成盐,不能与碳酸氢钠溶液反应,说明含有氨基,不含羧基,③能发生水解反应和银镜反应,说明含有酯基、醛基,④0.1摩尔G与足量金属钠反应可放出标况下2.24升氢气,含有2个羟基,可能的结构简式为 等,
等,
故答案为: ;
;
(5)苯丁酸氮芥中Cl原子、羧基均与足量氢氧化钠反应,反应方程式为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +2NaCl+H2O,
+2NaCl+H2O,
故答案为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +2NaCl+H2O;
+2NaCl+H2O;
(6)1,4-丁烯二醇与HCl发生加成反应,再发生催化氧化,然后会发生水解反应、酸化得到HOOC-CH=CH-COOH,最后与氢气发生加成反应得到HOOCCH2CH2COOH,合成路线流程图为: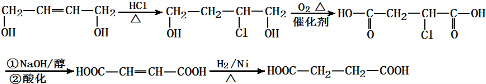 ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机物的结构与性质、有机反应类型、限制条件同分异构体的书写等,是对有机化学基础的综合考查,(4)中同分异构体的书写为易错点、难点,需要学生熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯( 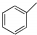 )的一氯代物 )的一氯代物 | D. | 立体烷 (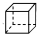 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| B. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据以上信息,可推断CH3COOH为弱电解质 | |
| B. | 加水稀释过程中,c(H+)•c(OH-) 的值增大 | |
| C. | 加入NaOH固体可抑制 CHCOO-的水解 | |
| D. | 同pH的CH3COONa溶液和NaOH溶液,由水电离出的c(H+) 前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
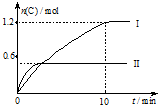 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1| 实验序号 | 温度 | 起始物质的量 | |
| A | B | ||
| Ⅰ | 600℃ | 1mol | 3mol |
| Ⅱ | 800℃ | 1.5mol | 0.5mol |
| A. | 实验 I中,10 min内平均反应速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中,a<0 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 molB,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com