
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
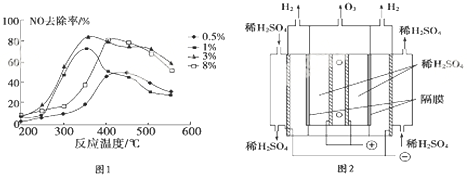
(2)根据图象找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
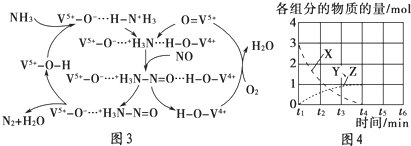
(3)②酸性条件下,水在阳极失电子生成臭氧;
③增大接触面积加快反应效率;
(4)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
(5)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物;
(6)9.2gNO2的物质的量$\frac{9.2g}{46g/mol}$=0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解溶液呈碱性.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1;
故答案为:-1250.3 kJ•mol-1;
(2)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高;
故答案为:350℃左右、3%;
(3)②酸性条件下,水在阳极失电子生成臭氧,生成1mol臭氧转移6mol电子,则电极方程式为:3H2O-6e-═O3↑+6H+;
故答案为:3H2O-6e-═O3↑+6H+;
③将石墨电极设置成颗粒状的目的是,增大吸收液与电极的接触面积,提高电解反应的效率
故答案为:增大吸收液与电极的接触面积,提高电解反应的效率;
(4)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
故答案为:N2;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:44.8L;
(5)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2;
故答案为:N2O、NO2;
(6)9.2gNO2的物质的量$\frac{9.2g}{46g/mol}$=0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2-水解溶液呈碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:2NO2+CO32-=NO3-+NO2-+CO2;c(NO3-)>c(NO2-)>c(OH-)>c(H+).
点评 本题考查了盖斯定律的应用、化学方程式的书写、电解原理的应用、氧化还原反应、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| D. | 元素电负性越大的原子,吸引电子的能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: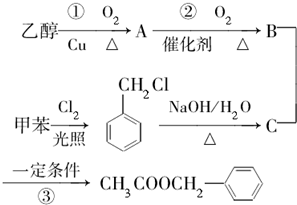
 .
.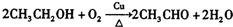 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com