
【题目】Ⅰ.水杨酸的结构简式为![]() ,
,
(1)下列关于水杨酸的叙述正确的是_______________。
A.![]() 与
与![]() 互为同系物
互为同系物
B.水杨酸分子中所有原子一定都在同一平面上
C.水杨酸既可以看成是酚类物质,也可以看成是羧酸类物质
(2)将水杨酸与___________________溶液作用,可以生成![]() ;请写出将
;请写出将![]() 转化为
转化为![]() 的化学方程式_______________。
的化学方程式_______________。
Ⅱ.用质谱法分析得知某链烃的相对分子质量为124。用酸性KMnO4溶液氧化,得到两种产物:a.CH3COOH, b.![]()
(3)b的名称为________________。
(4)该烃的分子式为________________;写出该烃可能的结构简式___________。
【答案】Ⅰ.(1)C
(2)NaOH或Na2CO3
![]() +NaHCO3→
+NaHCO3→![]() +H2O+CO2↑
+H2O+CO2↑
Ⅱ.(3)2-甲基丁二酸
(4)C9H16 ![]()
【解析】
试题分析:Ⅰ.(1)A.![]() 与
与![]() 官能团的种类不同,二者不是同系物,错误;B.水杨酸分子中所有原子不一定都在同一平面上,错误;C.水杨酸中含有酚羟基和羧基,既可以看成是酚类物质,也可以看成是羧酸类物质,正确,选C。
官能团的种类不同,二者不是同系物,错误;B.水杨酸分子中所有原子不一定都在同一平面上,错误;C.水杨酸中含有酚羟基和羧基,既可以看成是酚类物质,也可以看成是羧酸类物质,正确,选C。
(2)酸性:羧酸>苯酚>碳酸氢根,将水杨酸与NaOH或Na2CO3溶液作用,可以生成![]() ;
;![]() 与碳酸氢钠溶液反应生成
与碳酸氢钠溶液反应生成![]() ,化学方程式为
,化学方程式为![]() +NaHCO3→
+NaHCO3→![]() +H2O+CO2↑。
+H2O+CO2↑。
Ⅱ.(3)b的名称为2-甲基丁二酸。
(4)根据烯烃与酸性高锰酸钾溶液反应的规律知该烃的结构简式为![]() ,分子式为C9H16。
,分子式为C9H16。


科目:高中化学 来源: 题型:
【题目】已知H2(g)、CO(g)、CH3OH(l)的燃烧热![]() H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)= CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)= CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O(g) = 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列叙述正确的是( )
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16gO3所含的电子数为8NA
C.5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒中只有还原性的是( )
A. F-、CO、Na B. Na、I-、Zn
C. Fe2+、SO42-、NO3- D. Fe3+、O2、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O35H2O,式量248)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图1:
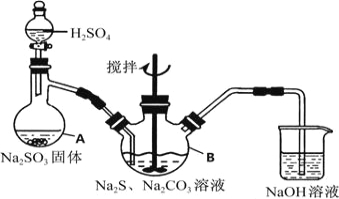
图1
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O35H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称 ,步骤④中洗涤时,为了减少产物的损失的试剂可以
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
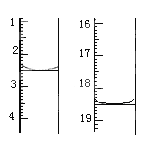
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000molL﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为 mL,产品的纯度为 %
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液中易被Cl2氧化SO42﹣,该反应的离子方程式为. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述的转化关系如图所示。下列说法正确的是( )

A. 原子半径:X<Y<Z
B. 非金属性:X>Y>Z
C. q与s均为酸性氧化物
D. X 的单质与Y 的单质在一定条件下能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
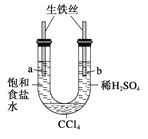
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com