
| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
分析 A.配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液体积偏小;
B.酸式滴定管只能量取酸性溶液,且其感量为0.01mL;
C.洗涤沉淀的方法是向漏斗中加蒸馏水浸没沉淀,待水自然流出后;
D.蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌,防止局部受热温度过高.
解答 解:A.配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液体积偏小,根据c=$\frac{n}{V}$知,导致配制溶液浓度偏高,故A正确;
B.酸式滴定管只能量取酸性溶液,且其感量为0.01mL,硝酸银是强酸弱碱盐,其水溶液呈酸性,所以量取15.20mL AgNO3溶液可以用酸式滴定管,故B正确;
C.洗涤沉淀的方法是向漏斗中加蒸馏水浸没沉淀,待水自然流出后,不能用玻璃棒搅拌,否则滤纸破损,故C错误;
D.蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌,防止局部受热温度过高,从而溅出液体产生安全事故,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、仪器选取及误差分析,明确实验原理、实验基本操作、物质性质是解本题关键,注意安全事故的发生,易错选项是AC.


科目:高中化学 来源: 题型:解答题
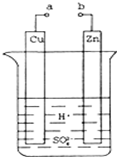 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
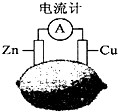
| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
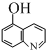 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: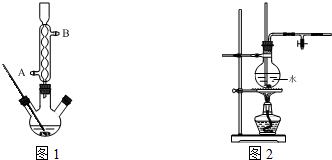
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
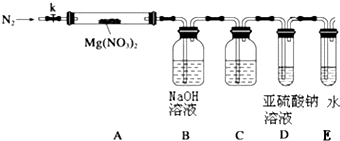 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com