
【题目】设NA为阿伏加德罗常数的值,则下列关于C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法正确的是( )
A.有10NA个电子转移时,吸收1300 kJ能量
B.有8NA个碳氧共用电子对生成时,放出1300 kJ能量
C.有NA个水分子生成且为液体时,吸收1300 kJ能量
D.有2NA个碳氧双键生成时,放出1300 kJ能量
科目:高中化学 来源: 题型:
【题目】硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶![]() 含
含![]() 、
、![]() 等杂质
等杂质![]() 的提纯流程如下。
的提纯流程如下。![]() 已知:硝酸锶、硝酸钡不溶于浓硝酸
已知:硝酸锶、硝酸钡不溶于浓硝酸![]()

![]() 要加快“酸浸”速率所采取的措施是_________
要加快“酸浸”速率所采取的措施是_________![]() 写一条即可
写一条即可![]() 。
。
![]() 操作1的名称是 _____________,洗涤所用的洗涤剂是 ________。
操作1的名称是 _____________,洗涤所用的洗涤剂是 ________。
![]() “滤液2”中过量的
“滤液2”中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式 _________;氧化产物与还原产物的物质的量之比为 _________。
,同时放出无污染的气体,写出发生反应的离子方程式 _________;氧化产物与还原产物的物质的量之比为 _________。
![]() 已知
已知![]() 不溶于水,还原后调节
不溶于水,还原后调节![]() 的目的是 ________。
的目的是 ________。
![]() 为了测定“残渣2”中Cr元素的质量分数,进行以下实验。
为了测定“残渣2”中Cr元素的质量分数,进行以下实验。![]() 已知:
已知:![]() 残渣
残渣![]()
![]() “残渣2”中Cr元素的质量分数为 _______
“残渣2”中Cr元素的质量分数为 _______![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会是 ________
若加入的HI溶液过量太多,测定结果会是 ________![]() 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”![]() ,其原因是 ______。
,其原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的无机功能材料,粗
是一种重要的无机功能材料,粗![]() 的提纯是工业生产的重要环节。某研究性学习小组设计了将粗
的提纯是工业生产的重要环节。某研究性学习小组设计了将粗![]() 含有较多的MnO和
含有较多的MnO和![]() 样品转化为纯
样品转化为纯![]() 实验,其流程如下:
实验,其流程如下:
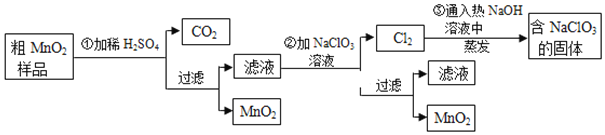
![]() 第
第![]() 步加稀
步加稀![]() 时,粗
时,粗![]() 样品中的______
样品中的______![]() 写化学式
写化学式![]() 转化为可溶性物质。
转化为可溶性物质。
![]() 第
第![]() 步反应的离子方程式: ______
步反应的离子方程式: ______![]() ______
______![]() ______
______
![]() 第
第![]() 步蒸发操作必需的仪器有铁架台
步蒸发操作必需的仪器有铁架台![]() 含铁圈
含铁圈![]() 、______、______、______,已知蒸发得到的固体中有
、______、______、______,已知蒸发得到的固体中有![]() 和NaOH,则一定还有含有______
和NaOH,则一定还有含有______![]() 写化学式
写化学式![]() 。
。
![]() 若粗
若粗![]() 样品的质量为
样品的质量为![]() ,第
,第![]() 步反应后,经过滤得到
步反应后,经过滤得到![]() ,并收集到
,并收集到![]() 标准状况下
标准状况下![]() ,则在第
,则在第![]() 步反应中至少需要______mol
步反应中至少需要______mol![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2+3H2![]() 2NH3合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。

①X的化学式为___;
②图中条件选定的主要原因是(选填字母序号)___;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。如图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号)___,当横坐标为温度时,变化趋势正确的是(选填字母序号)___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:

回答下列问题:
(1)“焙烧”时的硫酸浓度最好为_____(填标号)。
A.浓硫酸 B. 20%硫酸 C.50%硫酸 D. 80%硫酸
(2)“焙烧”过程中Cu2Se参与反应时,该反应的氧化产物是_______。
(3)“水吸收”所发生反应的化学方程式为____________。
(4)“过滤”所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
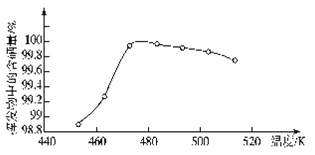
蒸馏操作中控制的最佳温度是_____(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
(5)“水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是____________________,“浸渣”中含有的金属单质是___________。
(6)若“浸出液”中,c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为___________________(已知:Ksp(Ag2SO4)=1.4×10-5,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种盐的稀溶液:amol·L-1NaX溶液和bmol·L-1NaY溶液。下列说法不正确的是( )
A.若a=b,且pH(NaX)>pH(NaY),则酸性HX<HY
B.若a>b,且c(X-)=c(Y-),则溶液中c(HX)>c(HY)
C.若a=b,且c(X-)=c(Y-)+c(HY),则HX为强酸
D.若两溶液等体积混合后c(X-)+c(HX)=c(Y-)+c(HY)=0.1mol·L-1,则a=b=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器的名称是_________________。
(2)烧杯间填满碎纸条的作用是___________________________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_______(填“偏大、偏小、无影响”)。
(4)如果用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热_______(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com