

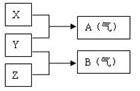
| A.M电极的材料是石墨 |
| B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C.在此过程中,甲池中OH-向通乙醇的一极移动 |
| D.在此过程中,乙池溶液中电子从M电极向N电极移动 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Ag + Zn(OH)2,下列说法正确的是
2Ag + Zn(OH)2,下列说法正确的是| A.放电时Zn参与反应的电极为正极 |
| B.放电时负极附近的pH逐渐增大 |
| C.充电时阴极的电极反应为:Zn(OH)2 -2e-= Zn + 2OH- |
| D.充电时每生成1 mol Ag2O转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
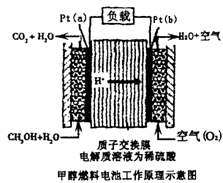
| A.a是负极,b是正极 |
| B.b极的电反应是:O2+4H++4e-=2H2O |
| C.甲醇在a极上得电子,发生还原反应 |
D.当电路上通过2mol电子消耗的CH3OH为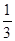 mol mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.p能级的原子轨道呈哑铃形,随着能层的增加,p能级原子轨道也在增多 |
| B.用电解法精炼粗铜时,粗铜作阴极 |
| C.强电解质溶液的导电能力一定比弱电解质溶液强 |
| D.铅蓄电池在放电过程中,正、负极质量都增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极发生的电极反应可能是O2+4e-+2H2O=4OH- |
| B.正极发生的电极反应可能是:O2+4e-=2O2- |
| C.正极反应主要是C6H12O6生成CO2或CO |
| D.负极反应主要是C6H12O6生成CO2或HCO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.电解水制取氢气是理想而经济的制氢方法 |
| B.发展氢燃料电池汽车不需要安全高效的储氢技术 |
| C.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
| D.氢燃料电池汽车的使用可以有效减少城市空气污染 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Na2Sx,以下说法错误的是
Na2Sx,以下说法错误的是| A.放电时,钠作负极,硫作正极 |
| B.若此电池用作电源电解饱和NaCl溶液,当阳极产生11.2L(标况)气体时,消耗金属钠23g |
| C.充电时,钠极与外电源的正极相连,硫极与外电源的负极相连 |
| D.充电时,阳极发生的反应是:Sx2--2e=xS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com