
| A、元素铯的两种核素137Cs比133Cs多4个质子 | B、S2-的结构示意图: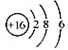 | C、质子数为53,中子数为78的碘原子:53131I | D、氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%=35.453中,75.77%表示35Cl的质量分数,35.453表示氯元素的相对原子质量 |
 ,故B错误;
,故B错误;

科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E | F | G |
| 化合价 | -2 | -1 | -2、+6 | +4、-4 | +3 | +1 | +4、-4 |
| 原子半径(nm) | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 | 0.077 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省安庆市六校高三第三次联考理综化学试卷(解析版) 题型:填空题
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
元素代号 | 相关信息 |
X | 它的一种核素的原子核内没有中子 |
Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
Z | 基态原子的最外层电子排布式为nsnnpn+1 |
W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq)??? ΔH=+45.6 KJ/mol
YZ- (aq)+X3W+(aq)??? ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1)??? ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省高二下学期期中考试化学试卷(解析版) 题型:填空题
(13分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
|
a |
|
|
|
|
|||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
|
|
|
|
|
e |
f |
|
|
|||||||||
|
|
|
|
|
|
g |
|
h |
|
|
|
|
|
|
|
|
|
|
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为 。
(2)在b2a2分子中,元素b为 杂化,该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
查看答案和解析>>
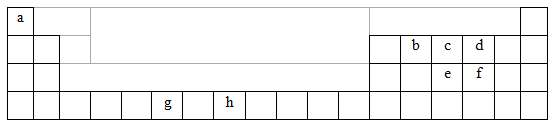
科目:高中化学 来源:辽宁省期中题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | ||||||||||||||||
| g | h | ||||||||||||||||
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式____________,h2+中未成对电子数为 ![]() 。
。
(2)在b2a2分子中,元素b为 杂化,![]() 该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3)bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A、h位于元素周期表中第四周期第VIII族,属于d区元素
B、e的基态原子中,3p能级为半充满,属于p区元素
C、最外层电子排布式为4s2,一定属于IIA族
D、最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素![]() b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com