
| A. | 标准状况下6.72 L CO | B. | 0.3NA个Na2SO3 | ||
| C. | 常温常压下9.6g O2 | D. | 1.806×1023个H2O分子 |
分析 n(SO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,含有O原子为0.6mol,根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算选项中各物质的物质的量,再结合化学式计算氧原子物质的量,据此判断.
解答 解:n(SO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,含有O原子为0.3mol×2=0.6mol,
A.标准状况下6.72 L CO的物质的量为,n(SO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则n(O)=n(CO)=0.3mol,故A不符合;
B.0.3NA个Na2SO3的物质的量为0.3mol,含有O原子为0.3mol×3=0.9mol,故B不符合;
C.常温常压下9.6g O2的物质的量为$\frac{9.6g}{32g/mol}$=0.3mol,含有O原子为0.3mol×2=0.6mol,故C符合;
D.1.806×1023个H2O分子物质的量为$\frac{1.806×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.3mol,含有O原子为0.3mol×1=0.3mol,故D不符合,
故选C.
点评 本题考查物质的量有关计算,注意对化学式的理解,侧重对学生基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向溶液乙中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| B. | 向溶液乙中滴加少量氢氧化钠溶液,一定出现红褐色沉淀 | |
| C. | 向溶液甲中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| D. | 该矿石一定为赤铁矿 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2V(正)(N2)=V(逆)(NH3) | B. | V(正)(N2)=3V(正)(H2) | ||
| C. | 2V(正)(H2)=3V(逆)(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,比较S2-与Cl-的半径大小:r(S2-)>(填“>”或“<”)r(Cl-).
,比较S2-与Cl-的半径大小:r(S2-)>(填“>”或“<”)r(Cl-).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
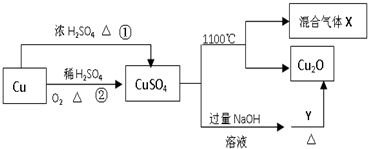
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可以是酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com