
| A. | 150mL0.2mol/L氢氧化钠溶液 | B. | 100mL0.3mol/L醋酸溶液 | ||
| C. | 200mL0.2mol/L硫酸溶液 | D. | 150mL0.2mol/L盐酸溶液 |
分析 溶液导电能力与离子浓度成正比,与电解质强弱无关,溶液导电能力最强说明该溶液中离子浓度最大,据此分析解答.
解答 解:溶液导电能力与离子浓度成正比,与电解质强弱无关,溶液导电能力最强说明该溶液中离子浓度最大,
A.0.2mol/LNaOH溶液中,NaOH是强电解质,完全电离,所以溶液中钠离子浓度为0.2mol/L;
B.醋酸是弱电解质,部分电离,所以0.3mol/L醋酸溶液中氢离子浓度远远小于0.2mol/L;
C.硫酸是强电解质,完全电离,所以0.2mol/L硫酸中氢离子浓度是0.4mol/L;
D.HCl是强电解质,完全电离,0.2mol/L盐酸中氢离子浓度是0.2mol/L;
通过以上分析知,离子浓度最大的是硫酸,故选C.
点评 本题考查电解质强弱、电解质的电离等 知识点,明确溶液导电能力与离子浓度关系是解本题关键,注意电解质溶液导电能力与溶液体积无关、与电解质强弱无关,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:
茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
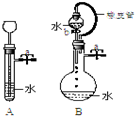 根据如图描述回答下列问题:
根据如图描述回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
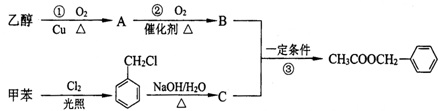
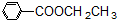 、
、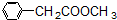 、
、
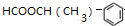 和
和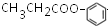 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
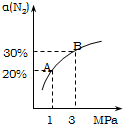 某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 保持压强不变,通入惰性气体,平衡常数不变,平衡不移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com