
| 180×60% |
| 12 |
| 180×4.44% |
| 1 |
| 180-12×9-8 |
| 16 |
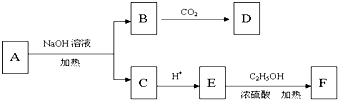
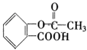 ,A在氢氧化钠溶液中发生水解反应生成B和C,C酸化生成E,E与乙醇发生酯化反应生成F,又F的分子式为C4H8O2,所以C、E都只含有2个碳,所以C为CH3COONa,B为
,A在氢氧化钠溶液中发生水解反应生成B和C,C酸化生成E,E与乙醇发生酯化反应生成F,又F的分子式为C4H8O2,所以C、E都只含有2个碳,所以C为CH3COONa,B为 ,E为CH3COOH,F为CH3COOCH2CH3,因为碳酸酸性比苯酚强但比羧酸弱,所以B与二氧化碳反应生成D的结构简式为
,E为CH3COOH,F为CH3COOCH2CH3,因为碳酸酸性比苯酚强但比羧酸弱,所以B与二氧化碳反应生成D的结构简式为 ,据此分析解答.
,据此分析解答.| 180×60% |
| 12 |
| 180×4.44% |
| 1 |
| 180-12×9-8 |
| 16 |
 ,A在氢氧化钠溶液中发生水解反应生成B和C,C酸化生成E,E与乙醇发生酯化反应生成F,又F的分子式为C4H8O2,所以C、E都只含有2个碳,所以C为CH3COONa,B为
,A在氢氧化钠溶液中发生水解反应生成B和C,C酸化生成E,E与乙醇发生酯化反应生成F,又F的分子式为C4H8O2,所以C、E都只含有2个碳,所以C为CH3COONa,B为 ,E为CH3COOH,F为CH3COOCH2CH3,因为碳酸酸性比苯酚强但比羧酸弱,所以B与二氧化碳反应生成D的结构简式为
,E为CH3COOH,F为CH3COOCH2CH3,因为碳酸酸性比苯酚强但比羧酸弱,所以B与二氧化碳反应生成D的结构简式为 ;
; ;E中所含官能团名称羧基,故答案为:
;E中所含官能团名称羧基,故答案为: ;羧基;
;羧基; +CO2+H2O→
+CO2+H2O→ +NaHCO3,
+NaHCO3,| 浓H2SO4 |
| △ |
 +CO2+H2O→
+CO2+H2O→ +NaHCO3;CH3COOH+CH3CH2OH
+NaHCO3;CH3COOH+CH3CH2OH | 浓H2SO4 |
| △ |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+ |
| C、石灰水与碳酸钠溶液混合:Ca2++CO32-=CaCO3↓ |
| D、硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
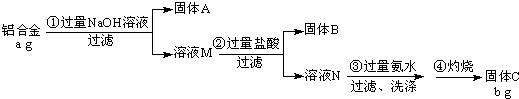
 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.| NaOH溶液 |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
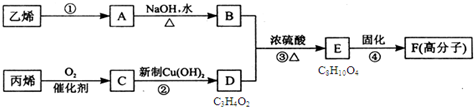
| A、反应④的反应类型是加聚 |
| B、物质A是卤代烃 |
| C、物质B催化氧化后可以得到乙醛 |
| D、1mol物质E最多可以消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
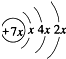 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com