
分析 (1)根据n=$\frac{m}{M}$计算出该气体的物质的量,再计算出含有原子的物质的量,然后根据N=nNA计算出含有原子数;根据V=nVm计算出该气体在标准状况下的体积;
(2)根据n=$\frac{V}{{V}_{m}}$计算混合气体的总的物质的量,设CO的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算二者物质的量之比,根据m=nM计算CO的质量,根据M=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量;
(3)根据n=$\frac{m}{M}$计算 Ca2+的物质的量,溶液中n(NO3-)=2n( Ca2+),根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算NO3-的物质的量浓度;
(4)根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,然后根据m=nM计算出氨气的质量,从而可知溶液质量,然后根据V=$\frac{m}{ρ}$计算出水的溶液体积,最后根据c=$\frac{n}{V}$计算出该溶液的浓度;
(5)a.相同条件下体积之比等于物质的量之比;
b.根据n=$\frac{V}{{V}_{m}}$计算6.72LCH4的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据n=$\frac{m}{M}$计算13.6gH2S的物质的量;
c.根据m=nM计算甲烷、HCl、氨气的质量;
d.根据各分子含有的H原子数目,计算各物质含有的H原子物质的量;
(6)体积之比等于物质的量之比,令氮气的物质的量为xmol,则氧气为2xmol,二氧化碳为3xmol,根据混合气体的质量,求算x的值,再根据V=nVm计算混合气体标准状况下体积.
解答 解:(1)该气体的物质的量为:n=$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,该气体分子中含有3个原子,则含有原子的物质的量为$\frac{m}{M}$mol×3=$\frac{3m}{M}$mol,含有原子数为:N=nNA=$\frac{3m}{M}$×NA=$\frac{3m}{M}$NA;标准状况下该气体的体积为:22.4L/mol×$\frac{m}{M}$mol=$\frac{22.4m}{M}$L,
故答案为:$\frac{3m}{M}$NA;$\frac{22.4m}{M}$;
(2)标准状况下,混合气体的物质的量为:$\frac{67.2L}{22.4L/mol}$=3mol,
设CO的物质的量为x,CO2的物质的量为y,则:
$\left\{\begin{array}{l}{x+y=3}\\{28x+44y=120}\end{array}\right.$,
解得:x=0.75mol,y=2.25mol,
此混合物中CO和CO2物质的量之比=0.75mol:2.25mol=1:3;
CO的质量为:m(CO)=0.75mol×28g/mol=21g;
混合气体的平均摩尔质量M=$\frac{120g}{3mol}$=40g/mol,
故答案为:1:3;21g;40g/mol;
(3)2g Ca2+的物质的量为:$\frac{2g}{40g/mol}$=0.05mol,溶液中n(NO3-)=2n( Ca2+)=0.05mol×2=0.1mol,溶液体积为:$\frac{40g}{1000ρg/L}$=$\frac{2}{50ρ}$L,NO3-的物质的量浓度为:$\frac{0.1mol}{\frac{2}{50ρ}L}$=2.5ρ mol/L,
故答案为:2.5ρ mol/L;
(4)标准状况下VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气的质量为:17g/mol×$\frac{V}{22.4}$mol=$\frac{17V}{22.4}$g,所得溶液的质量为:$\frac{17V}{22.4}$g+100g,所得溶液的体积为:$\frac{\frac{17V}{22.4}g+100g}{1000ag/L}$=$\frac{17V+2240}{22400a}$L,该溶液的物质的量浓度为:$\frac{\frac{V}{22.4}mol}{\frac{17V+2240}{22400}L}$=$\frac{1000aV}{17V+2240}$mol/L,
故答案为:$\frac{1000aV}{17V+2240}$mol/L;
(5)①6.72L CH4的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,②3.01×1023 个HCl分子的物质的量为:$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,③13.6g H2S的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,④0.2mol NH3,
a.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积④<①<③<②,故正确;
b.由上述计算可知,物质的量为④<①<③<②,故错误;
c.甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故正确;
d.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故正确;
故答案为:acd;
(6)体积之比等于物质的量之比,令氮气的物质的量为xmol,则氧气为2xmol,二氧化碳为3xmol,所以:xmol×28g/mol+2xmol×32g/mol+3xmol×44g/mol=20g,
解得:x=$\frac{20}{224}$mol,
所以标准状况下,混合气体的体积为($\frac{20}{224}$mol+2×$\frac{20}{224}$mol+3×$\frac{20}{224}$mol)×22.4L/mol=12L,
故答案为:12.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、气体摩尔体积、物质的量浓度等之间的关系为解答关键,试题知识点较多、综合性较强,充分考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
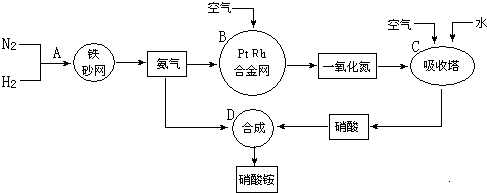
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl | B. | O | C. | KMnO4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在配制一定物质的量浓度溶液的实验中托盘天平,玻璃棒是必需仪器 | |
| B. | 实验室中,盛装NaOH等碱性溶液的试剂瓶用橡皮塞 | |
| C. | 加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时一定满足c(SO2)=2c(O2) | |
| B. | 增大压强,平衡向右移动,O2的浓度一定减小 | |
| C. | 增加O2的浓度,平衡向右移动,SO2的转化率增大 | |
| D. | 平衡向右移动时反应物的浓度减小,生成物的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
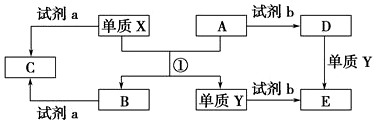
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=v(B) | B. | v(A)=2v(C) | C. | 2v(B)=3v(C) | D. | 3v(B)=v(D) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com