
| A. | 二糖分子中碳原子个数都是葡萄糖的两倍 | |
| B. | 二糖都是由两种单糖组成的混合物 | |
| C. | 二糖水解后都可以得到两种单糖 | |
| D. | 每分子二糖水解后都能生成两分子单糖 |
分析 A.蔗糖和麦芽糖分子式相同,都是C12H22O11,葡萄糖分子式为C6H12O6,核糖(C5H10O5)和脱氧核糖(C5H10O4)
B.二糖是由两个单糖分子经缩合反应除去一个水分子而成的糖;
C.麦芽糖水解只生成葡萄糖;
D.二糖水解后都能生成两分子单糖;
解答 解:A.不一定对的,葡萄糖、果糖、半乳糖由六个碳原子构成,称为六碳糖,核糖和脱氧核糖由五个碳原子组成的称为五碳糖,故A错误;
B.二糖不是由两种单糖组成的混合物,二糖是由两个单糖分子经缩合反应除去一个水分子而成的糖,属于纯净物,故B错误;
C.蔗糖水解生成葡萄糖和果糖,麦芽糖水解只生成葡萄糖,故C错误;
D.二糖是能水解生成两分子单糖的糖,这两分子单糖可以相同,也可以不同,故D正确;
故选D.
点评 本题考查糖类的性质,难度不大,注意蔗糖和麦芽糖分子式相同结构式不同,互为同分异构体,单糖不一定是六碳糖,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 铁粉、生石灰均可作食品抗氧化剂 | |
| B. | 明矾、氯化铁均可作净水剂 | |
| C. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| D. | 碘酒、双氧水均可用于伤口消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol H2O2分子中的非极性共价键数为NA | |
| B. | 1L 0.lmol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钢铁发生析氢腐蚀时,0.56gFe反应转移电子数为0.03NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
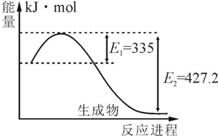 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
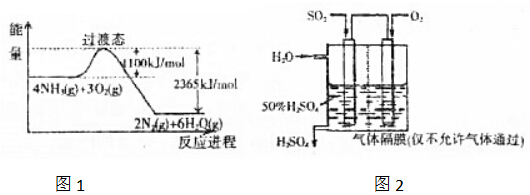
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 碱性溶液中:NO3-、I-、Na+、Fe2+ | |
| D. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A.任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B.常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C.常温常压下,22.4LH2O中含有的氢原子数为2NA
D.标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:实验编号 | NaOH溶液的浓度/(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com