
【题目】肼(N2H4)为二元弱碱,在水中的电离方式与NH3相似。25℃时,水合肼(N2H4·H2O)的电离常数K1、K2依次为9.55×10-7、1.26×10-15。下列推测或叙述一定错误的是
A.N2H4易溶于水和乙醇
B.N2H4分子中所有原子处于同一平面
C.N2H6Cl2溶液中:2c(N2H![]() )+c(N2H
)+c(N2H![]() )>c(Cl-)+c(OH-)
)>c(Cl-)+c(OH-)
D.25°C时,反应H++N2H4N2H![]() 的平衡常数K=9.55×107
的平衡常数K=9.55×107
科目:高中化学 来源: 题型:
【题目】如图是三种常见有机物的比例模型示意图.下列说法正确的是( )
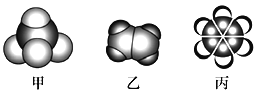
A. 甲在光照条件下与Cl2反应可得到四种不同的产物
B. 乙、丙所有的原子均处于同一平面,均可使溴水反应褪色
C. 石油分馏可获得甲和乙,煤干馏可获得丙
D. 在浓硫酸存在下,丙与浓硝酸共热的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=Fe3++NO↑+3H2O
⑤氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑥Fe(OH)3不可用Fe2O3与水反应得到,但能通过其它化合反应制取
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(aNaHSO2bHCHOcH2O)俗称吊白块,在印染、医药以及原子能工业中应用广泛。某化学兴趣小组以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛。已知次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上会发生分解。实验装置(如图1所示)及步骤如下:
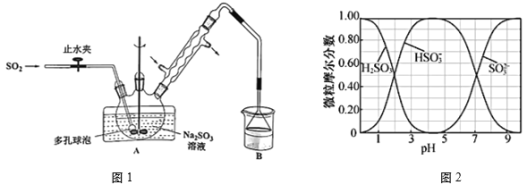
I.在三颈烧瓶中加入一定量的Na2SO3和水,搅拌溶解后缓慢通入SO2,制得NaHSO3溶液。
II.将装置A中导气管换成橡皮塞。向三颈烧瓶中加入稍过量的锌粉和一定量37%的甲醛溶液,不断搅拌,在80~90℃左右的水浴中反应约3h后趁热过滤,试剂X洗涤。
III.将滤液蒸发浓缩,冷却结晶,过滤;往滤液中加入适量试剂Y,析出晶体,过滤;合并滤渣,试剂Z洗涤,干燥得到产品。
请回答下列问题:
(1)Na2SO3水溶液中,含硫微粒H2SO3、HSO3-、SO32-随pH的分布如图2所示,则步骤I中确定何时停止通SO2的实验操作为___。
(2)下列说法中正确的是___。
A.B中烧杯中盛放的试剂可以是NaOH溶液
B.试剂Y是无水乙醇;试剂X与试剂Z都是乙醇的水溶液
C.冷凝管内冷凝回流的主要物质是HCHO
D.步骤III中所选择的干燥操作应为真空干燥
(3)步骤II中的水浴加热相比于与酒精灯直接加热,除了有使三颈烧瓶受热更均匀、较低温度下减少产物的分解之外,还有___的优点。化学兴趣小组的同学为完成所设计的实验,除图1中装置仪器外,还需要使用到的仪器有___。
(4)步骤III中蒸发浓缩时应注意的问题有___(并简要说明理由)。
(5)AHMT分光光度法常用于测定溶液样本中甲醛的浓度。其原理是:甲醛与AHMT溶液在碱性条件下缩合后,经高碘酸钾氧化成一种紫红色化合物,其对特定波长光的吸收程度(即色泽深浅)与甲醛在一定浓度范围内成正比。现测得该紫红色化合物的吸光度A与HCHO标准溶液的浓度关系如图3所示:
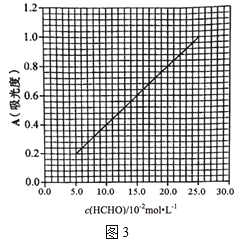
该化学兴趣小组的同学设计了如下实验确定次硫酸氢钠甲醛的组成:
I.准确称取1.5400g样品,完全溶于水配制成100mL溶液
II.取25.00mL所配溶液经AHMT分光光度法测得溶液吸光度A=0.4000
III.另取25.00mL所配溶液,加入过量碘完全反应后,再加入BaCl2溶液充分反应,得到0.5825g白色沉淀。其反应原理为:
aNaHSO2bHCHOcH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)。
①通过计算可知次硫酸氢钠甲醛的化学式为___。
②结合三颈烧瓶内发生的合成反应产物分析,题干的步骤II中,不断搅拌的目的为:___。
③若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物。写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。
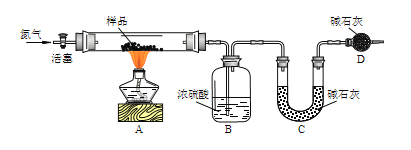
加热完毕再通一段时间氮气的作用是___。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。
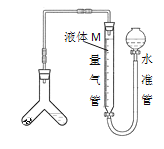
为了减小实验误差,量气管中液体M的选择原则是___。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
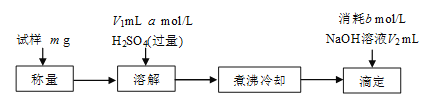
煮沸的目的主要是___。
若滴定时NaOH加入过量,则x值___(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体富营养化是由于水体中N、P等营养盐含量过多而引起的水质污染现象。去除水体中N、P的方法很多。
(1)化学沉淀法去除水体中的PO![]() ,常用的化合物有AlCl3、Ca(OH)2等。
,常用的化合物有AlCl3、Ca(OH)2等。
①AlCl3溶液中Al3+水解的离子方程式为___。
②Ca5(PO4)3OH的Ksp为6.8×10-37,其溶度积常数表达式为Ksp[Ca5(PO4)3OH]=___。
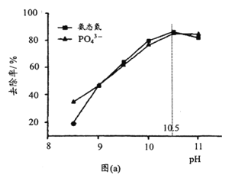
(2)为探究将废水中氨态氮(NH3—N)和PO![]() 同时去除,按n(NH4Cl):n(Na2HPO4):n(MgCl2)=1:1:1加入水中,实验测得不同pH下,氨态氮和PO
同时去除,按n(NH4Cl):n(Na2HPO4):n(MgCl2)=1:1:1加入水中,实验测得不同pH下,氨态氮和PO![]() 的去除率如图(a)所示:
的去除率如图(a)所示:
已知:(I)去除的主要反应为:Mg2++NH![]() +HPO
+HPO![]() +6H2O
+6H2O![]() MgNH4PO4·6H2O↓+H+,
MgNH4PO4·6H2O↓+H+,
(II)室温时,Ksp(MgNH4PO4·6H2O)=2.5×10-13,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mg3(PO4)2]= 6.3×10-31。
①pH在8.5~10.5时,氨态氮和PO![]() 去除率随pH增大而增大,其原因是___ (从平衡移动角度说明)。
去除率随pH增大而增大,其原因是___ (从平衡移动角度说明)。
②当pH>10.5时,氨态氮和PO![]() 去除率随pH增大而减小,其原因是___(从平衡移动角度说明)。
去除率随pH增大而减小,其原因是___(从平衡移动角度说明)。
(3)一种浸没式SMDDC电池可用于去除地下水中硝态氮,其装置如图(b)所示:
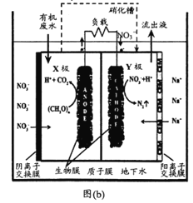
①装置工作时,H+向___极(填“X”或“Y")室迁移。
②X极上(CH2O)n→CO2的电极反应式为___;Y极上NO![]() →N2的电极反应式为___。
→N2的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
| 滴管 | 试管 | |
0.2molL-1 CuSO4溶液 | 0.2molL-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 | |
0.2molL-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 | ||
0.2molL-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 | ||
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___,氧化产物与还原产物的物质的量之比为___。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3yCu(OH)2zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3yCu(OH)2zH2O与氢气反应的化学方程式___;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___→gf→___→___→___→l
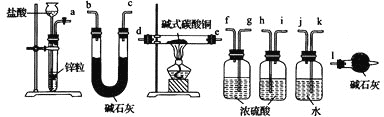
(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是___。
b.证实沉淀中含有Cu2+和SO32-的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
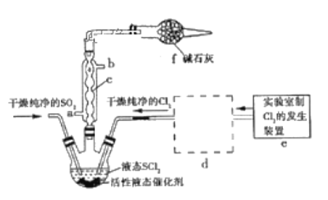
请回答下列问题:
(1)仪器c的名称是_______________;
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为________________________________;
(3)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是_______________________;
(4)若反应中消耗Cl2的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(5)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.尼泊金酸与碳酸氢钠反应:![]() +2HCO
+2HCO![]()
![]()
![]() +2CO2
+2CO2![]() +2H2O
+2H2O
B.醋酸溶液与新制氢氧化铜反应:2 H++Cu(OH)2→Cu2++2H2O
C.苯酚钠溶液中通入少量二氧化碳: C6H5O-+CO2 +H2O → C6H5OH+HCO![]()
D.甲醛溶液与足量的银氨溶液共热HCHO+2[Ag(NH3)2]++2OH-![]() CO
CO![]() +2NH
+2NH![]() + 2Ag↓+ 2NH3+ H2O
+ 2Ag↓+ 2NH3+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com