
少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
将1 000 mL 0.1 mol·L-1BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1 000 mL 0.5 mol·L-1HCl溶液与足量CH3COONa溶液充分反应放出b kJ 热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a-2b) kJ B.(2b-5a) kJ C.(10a+4b)kJ D.(5a+2b)kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)

A.M+>H+>N3+
B .M+>N3+>H+
.M+>N3+>H+
C.N3+>H+>M+
D.条件不足,无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
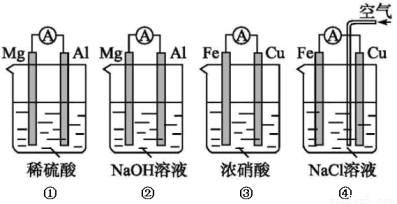
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e -=H2↑
-=H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
50mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
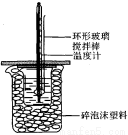
(1)大小烧杯间填满碎泡沫塑料的作用是_______________。
(2)_________(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是__________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是________(填“偏高”“偏低”或“无影响”)。
(4)如果改用60mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_______(填“增加” “减少”或“不变”),理由是_____________;所求中和热数值_________(填“增加”“减少”或“不变”),理由是_______________;
(5)________(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是______________________.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/ ℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10—3kJ/(g·℃),则该反应的中和热为△H=____________(保留小数点后一位)。
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰 视读数
视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且 不影响生成氢气的总量,可向盐酸中加入适量的:
不影响生成氢气的总量,可向盐酸中加入适量的:
①NaOH固体;②H20;③CH3COONa固体;④NaN03固体;⑤KCl溶液。
A.①② B.②③⑤ C.②④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水;无水CaCl2 固体 | B. | 饱和NaHCO3 溶液; 浓H2SO4 | ||
| C. | 浓H2SO4; 饱和NaHCO3 溶液 | D. | 饱和NaHCO3 溶液; 稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molSO2和1molO2在一定条件下充分反应后,混合物的分子数为2NA | |
| B. | 25℃时,1L,pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 用惰性电极电解1L浓度均为0.2mol/L的Cu(NO3)2和AgNO3的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 | |
| D. | 电解精炼铜(粗铜含铁、锌、银、金杂质),阴极析出1 mol Cu,阳极失去的电子数小于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com