
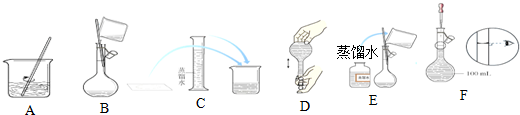
| A. | 向盛有10mL水的量筒中倒入浓硫酸即得稀硫酸 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 |
分析 A.量筒不能用于配制溶液;
B.胶头滴管的下端不能接触试管内壁,避免污染试剂;
C.不能将试纸浸入溶液中,否则会造成试剂污染;
D.使用托盘天平时遵循左物右码的原则.
解答 解:A.量筒不能用于配制溶液,且应将浓硫酸倒入水中,故A错误;
B.向试管中滴加试剂时,将滴管下端不能试管内壁,否则容易组成试剂的污染,故B错误;
C.使用试纸检验溶液的性质时,不可将试纸浸入溶液中,否则会组成试剂污染,可以使用玻璃棒蘸取少量溶液进行检验,故C错误;
D.根据天平称量方法可知,用托盘天平称量药品时,左盘放药品,右盘放砝码,二者不能颠倒,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及计量仪器及其使用方法、试纸的使用方法,题目难度不大,注意掌握常见计量仪器及其使用方法,明确试纸的正确使用方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与NA个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为2×6.02×1023 | |
| D. | 标准状况下,0.5NA分氟化氢分子所占体积是11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4、KNO3、Na2CO3、NH4Cl | B. | H2SO4、BaCl2、Na2SO4、NaOH | ||
| C. | MgCl2、AgNO3、KNO3、HCl | D. | NH4HCO3、NaOH、NaCl、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
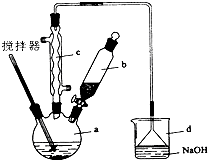 实验室制备苯乙酮的化学方程式为:
实验室制备苯乙酮的化学方程式为: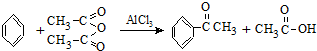
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com