
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为______________ g.
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为____________________.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
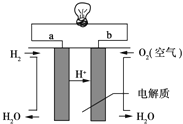
①氢氧燃料电池的总反应化学方程式是:__________________.
②电池工作一段时间后硫酸溶液的浓度___________(填“增大”、“减小”或“不变”).
【答案】Cu6.4gB2H2+O2=2H2O减小
【解析】
(1)该电池反应中铜失去电子发生氧化反应,做负极,当线路中转移0.2mol电子时,反应的铜为0.1mol,质量为6.4g;(2) 铜和铝插入浓硝酸溶液中,金属铝会钝化,金属铜和浓硝酸之间发生自发的氧化还原反应,此时金属铜做负极,金属铝做正极,插入氢氧化钠溶液中,金属铜和氢氧化钠溶液不反应,铝和氢氧化钠溶液发生自发的氧化还原反应,此时金属铝做负极,铜做正极。 (3) ①氢氧燃料电池中通入氧气的一极为正极,通入氢气的一极为负极,总反应为 2H2+O2=2H2O,②根据总反应分析,电池工作一段时间后,生成水,使溶液的体积增大,则硫酸的浓度减小。


科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
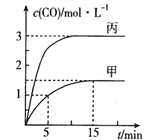
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T1 |
起始量 | 1mol C(s) 1mol H2O(g) | 1mol CO(g) 1mol H2(g) | 3mol C(s) 2mol H2O(g) |
下列说法正确的是
A. 甲容器中,反应在5~15mim间的平均速率v(CO)=0.15mol·L-1·min-1
B. 温度为T1℃时,反应的平衡常数K=9
C. 乙容器中,若平衡时n(C)=0.2mol,则T2<T1
D. 丙容器的体积V=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
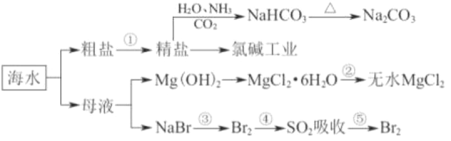
A. 工业上通过电解饱和MgCl2溶液制取金属镁
B. 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在③、④、⑤步骤中,溴元素均被氧化
D. 制取NaHCO3的反应是利用其溶解度比较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 化学反应中每生成1molO2,转移的电子数为4NA
D. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究的重要方法。相同质量的铁粉与足量稀硫酸分别在下列条件下发生反应,其中反应速率最快的是
A | B | C | D | |
t/℃ | 10 | 10 | 40 | 40 |
c(H2SO4 )/(mol/L) | 1 | 3 | 1 | 3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向逆反应方向移动
D. 物质C的质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com