
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
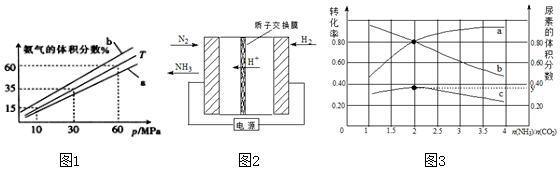
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)平衡常数随温度变化,与压强和浓度变化无关,平衡常数变化结合反应一定原理分析判断;
(3)A.由图可知,温度一定时,压强增大氨气的体积分数增大;
B.合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低,氮气的转化率越高;
D.不同物质表示的正逆速率之比等于化学计量数之比,说明可逆反应到达平衡;
设参加反应的氮气为n mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
根据平衡时氨气的体积分数方程式计算n,进而计算氮气的转化率;
(4)通入H2的一极为化合价升高,发生氧化反应,该极为阳极;合成氨的阴极上氮气得到电子生成氨气;
(5)由图可知,横坐标为$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=2时,尿素的体积分数最大,氨气的转化率为80%,以此计算该条件下反应的平衡常数K.
解答 解:(1)已知:
①2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9 kJ•mol-1
②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1
由盖斯定律②×3-①×2得到热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,K1>K2;
故答案为:>;反应是放热反应,温度升高,平衡逆向进行,平衡常数减小;
(3)A.由图可知,温度一定时,压强增大氨气的体积分数增大,故A正确;
B.图B中T=500℃,合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大,则温度为450℃时对应的曲线是b,故B正确;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低氮气的转化率越高,高温不利于氮气的转化,故C错误;
D.当 3v正(H2)=2v逆(NH3)时,正逆速率不等,不同物质表示的正逆速率之比等于化学计量数之比,应为2v正(H2)=3v逆(NH3),反应到达平衡,故D错误;
故选:AB;
②设参加反应的氮气为n mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
则$\frac{2n}{10-n+40-3n+2n}$×100%=25%,解得n≈5,所以氮气的转化率为$\frac{5mol}{10mol}$×100%=50%,
故答案为:50%;
(4)通入H2的一极为化合价升高,发生氧化反应,该极为阳极;,合成氨的阴极反应为N2+6H++6e-=2NH3,
故答案为:阳极;N2+6H++6e-=2NH3;
(5)由图可知,横坐标为$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=2时,尿素的体积分数最大,且氨气的转化率为80%,
2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)
起始浓度(mol.L-1 ) 1 0.5 0 0
变化浓度(ol.L-1 ) 0.8 0.4 0.4 0.4
平衡浓度(mol.L-1 ) 0.2 0.1 0.4 0.4
该条件下反应的平衡常数K=$\frac{c(CO(N{H}_{2})_{2}•c({H}_{2}O)}{{c}^{2}(N{H}_{3})•c(C{O}_{2})}$=$\frac{0.4×0.4}{0.{2}^{2}×0.1}$=40,
故答案为:2;40;
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学反应能量变化图象分析,平衡标志、平衡常数和平衡计算的判断计算是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液呈红色的溶液中:K+、Na+、SO42-、NO3- | |
| B. | 使pH试纸呈红色的溶液中:Fe3+、Na+、SCN-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、AlO2-、SO42-、NO3- | |
| D. | 加入Al粉能产生H2的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
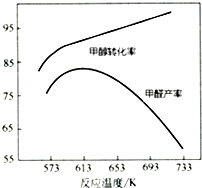 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
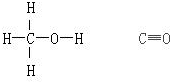
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com