
���� ��ɫ��֪һ������Fe3+��Fe2+��
��1�����������ϡ���ᣬ�а�ɫ�������ɣ�����ΪAgCl����һ����Ag+��
��2�����ˣ�����Һ���������ϡ���ᣬ���а�ɫ�������ɣ���ɫ����Ϊ���ᱵ����֪һ����Ba2+���Դ������
��� �⣺��1��������������֪��һ����Ag+��Ba2+��һ������Fe3+��Fe2+���ʴ�Ϊ��Ag+��Ba2+��Fe3+��Fe2+��
��2��������������֪������ȷ���Ƿ�K+��Ҫȷ���������ӵ�ʵ�鷽������ɫ��Ӧ����Ϊ��ɫ���������ӣ���֮�������ʴ�Ϊ����ɫ��Ӧ��
���� ���⿼�鳣�����ӵļ��飬Ϊ��Ƶ���㣬��������֮��ķ�Ӧ�����������Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע����ɫ���Ӽ���ɫ��Ӧ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������CH3COONa���� | B�� | ͨ������HCl���� | ||
| C�� | �����¶� | D�� | ��������NaOH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
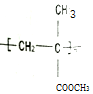 ����д����ΪPMMA���׳��л�����������˵���д�����ǣ�������
����д����ΪPMMA���׳��л�����������˵���д�����ǣ�������| A�� | �ϳ�PMMA�ĵ����Ǽ���ϩ��ͼ״� | |
| B�� | �ۼ���ϩ������ķ���ʽ�ɱ�ʾΪ��C5H8O2��n | |
| C�� | �ۼ���ϩ����������л��߷��Ӻϳɲ��� | |
| D�� | ����ϩ�����[CH2=C��CH3��COOCH3]��̼ԭ�ӿ��ܶ�����ͬһƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ������Ag+Ũ���й� | B�� | Ag2+Ҳ�Ǹ÷�Ӧ�Ĵ��� | ||
| C�� | Ag+�ܽ��÷�Ӧ�Ļ�ܺ��ʱ� | D�� | v��Cr3+��=v��S2O82-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�鷽�� | ʵ������ | ���� |
| ����Һ�м�KSCN��Һ | ��Һ���ɫ | ������������FeCl3 |
| ������KMnO4��Һ�м�����A��Һ | KMnO4��Һ��ɫ�����Ա仯 | ���������в���FeCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
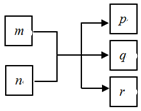 ������Ԫ��W��X��Y��Z��ԭ���������������ҷֲ���������ͬ�������YԪ�ص���ɫΪ��ɫ��������Ԫ����ɵ�����֮���ת����ϵ��ͼ����Ӧ������ȥ��������m��n��p�����q��r�ǵ��ʣ�rͨ��Ϊ����ɫ���壬������0.01mol•L-1 p��Һ��pHΪ12������˵������ȷ���ǣ�������
������Ԫ��W��X��Y��Z��ԭ���������������ҷֲ���������ͬ�������YԪ�ص���ɫΪ��ɫ��������Ԫ����ɵ�����֮���ת����ϵ��ͼ����Ӧ������ȥ��������m��n��p�����q��r�ǵ��ʣ�rͨ��Ϊ����ɫ���壬������0.01mol•L-1 p��Һ��pHΪ12������˵������ȷ���ǣ�������| A�� | �����Ӱ뾶�Ĵ�С��Y��X��Z | |
| B�� | X�ļ��⻯��ķе���ͬ��Ԫ������� | |
| C�� | Y�ֱ���W��Z�γɵ����ֻ������л�ѧ��������ͬ | |
| D�� | Z���������Ӧ��ˮ����Ϊǿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ������ijͬѧѧϰ��Ԫ�ص�ѧϰ������
������ijͬѧѧϰ��Ԫ�ص�ѧϰ������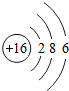 ���ӽṹ֪����Ԫ����һ�ֵ��ͷǽ���Ԫ�أ�
���ӽṹ֪����Ԫ����һ�ֵ��ͷǽ���Ԫ�أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.7�˽�������Ϊ������ʱʧȥ�ĵ�����ĿΪ0.3NA | |
| B�� | ��״����0.5molN2���еķ�����Ϊ0.5NA | |
| C�� | �ڳ��¡���ѹ�£�1molHCl��H2O��I2�����еķ�������Ϊ NA | |
| D�� | ��ͬ�¡�ͬѹ�£���ͬ���ʵ������κ����嵥�������е�ԭ������ͬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com