
【题目】现有原子序数小于20的A,B,C,D,E,F6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B,D两元素原子核内质子数之和的1/2;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答下列问题。
(1)用电子式表示C和E形成化合物的过程________________。
(2)写出基态F原子核外电子排布式__________________。
(3)写出A2D的电子式________,其分子中________(填“含”或“不含”)σ键,________(填“含”或“不含”)π键。
(4)A,B,C共同形成的化合物化学式为________,其中化学键的类型有________。
【答案】Na![]()
![]() :―→Na+[:
:―→Na+[:![]() :]- 1s22s22p63s23p64s1 H:
:]- 1s22s22p63s23p64s1 H:![]() :H 含 不含 NaOH 离子键、共价键
:H 含 不含 NaOH 离子键、共价键
【解析】
已知B元素是地壳中含量最多的元素,则B为氧元素;B和D的价电子数相同,则D为硫元素;B、D两元素原子核内质子数之和24,其1/2为12,A和C的价电子数相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的1/2,则A为氢元素,C为钠元素; C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子,则E为氯元素;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族,则F为钾元素;据以上分析解答。
已知B元素是地壳中含量最多的元素,则B为氧元素;B和D的价电子数相同,则D为硫元素;B、D两元素原子核内质子数之和24,其1/2为12,A和C的价电子数相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的1/2,则A为氢元素,C为钠元素;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子,则E为氯元素;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族,则F为钾元素,
(1)结合以上分析可知,C为钠元素,E为氯元素;C和E形成化合物为氯化钠,属于离子化合物,用电子式表示氯化钠形成化合物的过程如下:Na![]()
![]() :―→Na+[:
:―→Na+[:![]() :]- ;综上所述,本题答案是:Na
:]- ;综上所述,本题答案是:Na![]()
![]() :―→Na+[:
:―→Na+[:![]() :]-。
:]-。
(2) 结合以上分析可知,F为钾,核电荷数为19,基态K原子核外电子排布式: 1s22s22p63s23p64s1;综上所述,本题答案是:1s22s22p63s23p64s1。
(3) 结合以上分析可知,A为氢元素,D为硫元素;二者形成H2S,属于共价化合为物,电子式:H:![]() :H ;其分子中含σ键,不含π键;综上所述,本题答案是:H:
:H ;其分子中含σ键,不含π键;综上所述,本题答案是:H:![]() :H,含,不含。
:H,含,不含。
(4)A为氢元素,B为氧元素,C为钠元素,三种元素共同形成的化合物化学式为NaOH ,其电子式为:![]() , 化学键的类型有离子键、共价键;综上所述,本题答案是:NaOH,离子键、共价键。
, 化学键的类型有离子键、共价键;综上所述,本题答案是:NaOH,离子键、共价键。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:______________________。当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是______________________。
(4)写出用N2H4制备Cu2O的化学方程式:______________________,操作X包括___________、洗涤、烘干,其中烘干时要隔绝空气,其目的是___________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为______________________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.都能与氢氧化钠溶液反应
(3)铍、镁晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点比镁的熔点高,原因是_____________________________________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如图所示的链状结构(c)。

①a属于_____“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________(标出配位键)。
③c中Be原子的杂化方式为_____。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B.σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如图所示。

①BeO晶体中,O2﹣的配位数为_____。
②若BeO晶体的密度为dg/cm3,BeO的摩尔质量为Mg·mol-1,阿伏伽德罗常数为NA,则晶胞参数a=_______________ cm (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布
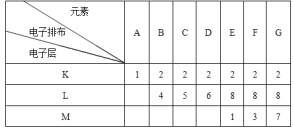
试由上述元素构成的物质的化学式回答:
(1)写出四种常见的由非极性键形成的双原子分子_____,
(2)写出三种由极性键形成的双原子分子___________,
(3)写出由极性键构成的直线形的三原子分子__,
(4)写出由三原子以极性键构成的空间构型为V形的三原子分子__,其电子式为___,
(5)写出一种由三个原子组成的既含离子键又含共价键的化合物___,其电子式为__________。
(6)写出一种既含离子键又含非极性键的化合物_____,其电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国的丹尼尔·诺切拉博士公布了自己团队研发的“人造树叶”,它可以与燃料电池共同构成一个新的发电装置——太阳能燃料电池,工作原理如图所示,下列有关叙述正确的是


A.太阳能燃料电池的优点为无论天气如何,均能持续供应电能,并且实现对环境的“零排放”
B.图A中塑料薄膜上部的反应为2H++2e-![]() H2↑
H2↑
C.图B燃料电池工作时的负极反应物为O2
D.“人造树叶”上发生的反应为6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就转移、定容,所配制的溶液浓度偏大
B. 用广泛pH试纸测得氯水的pH为3
C. 用托盘天平称取5.86g食盐
D. 用细铁丝放在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,透过蓝色钴玻璃观察火焰呈紫色,说明待测液中一定含有K+,没有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,反应4Fe(OH)2(s)+ 2 H2O(l)+ O2(g)═ 4 Fe(OH)3(s)能自发进行,则△ H<0
B. 有气体参与的可逆反应,在一定条件下达到平衡时,改变压强平衡一定发生移动
C. 化学平衡常数只与温度有关,与化学计量数无关
D. t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)NO(g)+SO3(g),通入少量O2,![]() 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com