
分析 (1)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,盐酸中的氯的化合价部分变,部分升高,所以盐酸具有酸性和还原性;
(2)根据氧化还原反应和制取氯气的化学方程式分析.
解答 解:(1)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,盐酸中的氯的化合价部分变,部分升高,所以盐酸具有酸性和还原性,故答案为:酸性和还原性;
(2)15.9gKMnO4的物质的量为$\frac{15.9g}{158g/mol}$=0.1mol,则:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 16 5
0.1mol n(HCl) n(Cl2)
所以,n(Cl2)=$\frac{0.1mol×5}{2}$=0.25mol,被氧化的HCl生成氯气,故被氧化的HCl的物质的量为0.25mol×2=0.5mol,
故答案为:0.5mol.
点评 本题考查了实验室制取氯气的反应原理和根据化学方程式的计算,以及与制取氯气有关的氧化还原反应知识,较为综合,也较为基础,能很好地考查知识和能力.


科目:高中化学 来源: 题型:选择题
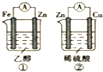
| A. | ①、②装置都能将化学能转化为电能 | |
| B. | ②中的硫酸根离子向负极移动 | |
| C. | ②中的电子轴Zn经过导线流向Cu | |
| D. | ②中铜片上发生的电极反应式为2H++2e-=2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
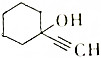 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮( 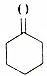 ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )| A. | 1:1 | B. | 1:2 | C. | 13:49 | D. | 24:49 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
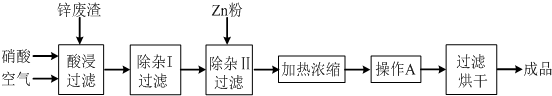
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
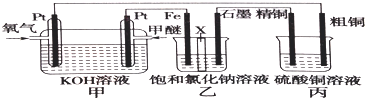
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol N2 | B. | 含NA个分子的Cl2 | ||
| C. | 标准状况下11.2 L的CH4 | D. | 6 g H2 (H2摩尔质量为2 g•mol-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为7 | B. | 周期表中第一电离能最小 | ||
| C. | 周期表中原子半径最大 | D. | 周期表中电负性最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com