解:(1)检验实验装置的气密性常用的做法是加热或形成液面差,以形成压强差来观察是否有气泡或液面是否发生变化,长颈漏斗没有塞子,必须加水至漏斗内液面高于锥形瓶内液面,形成密闭系统并形成压强差,观察液面变化,
故答案为:关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气;
(2)D为实验室制备氯气的发生装置,反应为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑2H
2O,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl
2+SO
2+2H
2O═4H
++2Cl
-+SO
42-,故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑2H
2O;Cl
2+SO
2+2H
2O═4H
++2Cl
-+SO
42-;
(3)根据硫元素守恒计算,
Na
2SO
3~SO
2~BaSO
4
126g 233g
m bg
m=
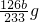
,所以Na
2SO
3的质量分数为
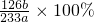
,故答案为:
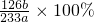
;
(4)氯气在NaOH溶液中反应生成NaCl和NaClO,反应为:Cl
2+2OH
-═Cl
-+ClO
-+2H
2O,故答案为:Cl
2+2OH
-═Cl
-+ClO
-+2H
2O;
(5)亚硫酸钠中混有硫酸钠,设计实验方案时可从两个角度设计:一是测定亚硫酸钠的含量,二是测定硫酸钠的含量,亚硫酸钠被氧化为硫酸钠,加入氯化钡生成硫酸钡沉淀,根据硫酸钡的质量求解硫酸钠的质量,可计算出亚硫酸钠的质量,题中从第一个角度设计,本题可从第二个角度设计,加入盐酸除去亚硫酸钠,加入氯化钡生成硫酸钡沉淀,根据硫酸钡的质量求解硫酸钠的质量,可计算出亚硫酸钠的质量,
故答案为:①②④;一定质量的Na
2SO
3样品于试管中,加入适量的蒸馏水溶解,加入过量的稀盐酸,不再产生气泡,再加入足量的BaCl
2溶液充分反应,过滤,洗涤,干燥,称重,求算出被氧化的Na
2SO
3的量,即可求算出无水亚硫酸钠被氧化的百分含量.
分析:(1)长颈漏斗没有塞子,必须加水至漏斗内液面高于锥形瓶内液面,形成密闭系统并形成压强差,观察液面变化;
(2)D为实验室制备氯气的发生装置,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(3)根据硫元素守恒计算,Na
2SO
3~SO
2~BaSO
4;
(4)C中为NaOH溶液,氯气在其溶液中反应生成NaCl和NaClO;
(5)亚硫酸钠被氧化为硫酸钠,加入氯化钡生成硫酸钡沉淀,以此计算百分含量.
点评:本实验比较常规,应该说是考查基础知识的掌握程度.(1)考查装置气密性检查的方法;(2)考查尾气处理;(3)方程式书写;(4)考查实验设计能力.

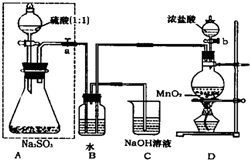 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题: MnCl2+Cl2↑2H2O,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑2H2O,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-,故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑2H2O;Cl2+SO2+2H2O═4H++2Cl-+SO42-;
MnCl2+Cl2↑2H2O;Cl2+SO2+2H2O═4H++2Cl-+SO42-;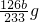 ,所以Na2SO3的质量分数为
,所以Na2SO3的质量分数为 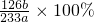 ,故答案为:
,故答案为: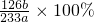 ;
; 

 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案: