
分析 反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑,若有8mol浓盐酸参加反应,消耗1mol的KMnO4,生成2.5mol的氯气,结合m=nM,V=nVm计算求解;
解答 解:反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑,若有8mol浓盐酸参加反应,消耗1mol的KMnO4,生成2.5mol的氯气,
(1)参与反应KMnO4的质量为:1mol×158g/mol=158g,答:参与反应KMnO4的质量为158g;
(2)标准状况下,生成氯气的体积为:2.5mol×22.4L/mol=56L,答:标准状况下,生成56L的Cl2.
点评 本题考查氧化还原反应的计算,难度不大,学生根据方程式直观简单,关键列等式.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
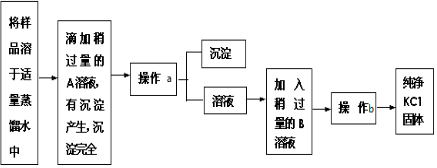
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
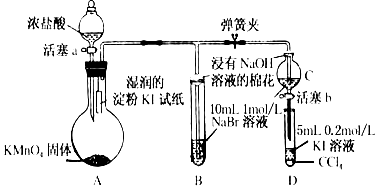
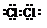
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
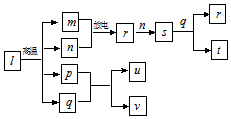 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )| A. | 原子半径:r(X)<r(Z)<r(Y) | |
| B. | 简单氢化物的稳定性:Z>W>Y | |
| C. | 上述转化关系中的物质的类别有单质、酸及酸性氧化物等 | |
| D. | X、Y、Z三种元素形成的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向盛有0.5mol•L-1Fe(NO3)2溶液的试管中加入0.5mol•L-1H2SO4溶液 | 在试管口处出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向PbI2饱和溶液中滴加几滴0.1mol•L-1KI溶液 | 出现黄色沉淀 | 说明 PbI2饱和溶液中有Pb2+存在 |
| C | 向白色ZnS沉淀上滴加0.1mol•L-1CuSO4溶液,振摇 | 沉淀变为黑色 | ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq) ?CuS(s)+Zn2+(aq) |
| D | 相同条件下,用1mol•L-1醋酸溶液和1mol•L-1盐酸分别做导电性实验 | 醋酸溶液对应的灯泡较暗 | 醋酸是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液pH=7 | |
| B. | 25℃时,0.2 mol•L-1 Ba(OH)2溶液和0.2 mol•L-1 HCl等体积混合,所得溶液pH=7 | |
| C. | 25℃时,0.2 mol•L-1 NaOH溶液和0.2 mol•L-1 CH3COOH恰好中和,所得溶液pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com