
【题目】某学生为了验证苯酚、醋酸和碳酸的酸性强弱,设计了如图所示实验装置。
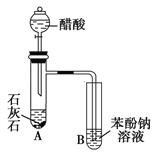
请回答下列问题:
(1)仪器B中的实验现象:____________________________________________。
(2)仪器B中发生反应的化学方程式是___________________________。
(3)该实验设计不严密,请改正:____________________________________________________________。
【答案】 溶液由澄清变浑浊 C6H5ONa+H2O+CO2![]() C6H5OH+NaHCO3 在A、B之间连接一个洗气瓶,洗气瓶内盛饱和碳酸氢钠溶液,吸收挥发出来的醋酸
C6H5OH+NaHCO3 在A、B之间连接一个洗气瓶,洗气瓶内盛饱和碳酸氢钠溶液,吸收挥发出来的醋酸
【解析】试题分析:(1)醋酸与石灰石反应生成CO2,碳酸的酸性强于苯酚的。因此CO2通入到苯酚钠溶液中会生成苯酚,所以仪器B中的实验现象是溶液由澄清变浑浊。
(2)由于碳酸的酸性强于苯酚的,而苯酚的酸性又强于碳酸氢纳的,所以CO2与苯酚钠反应生成苯酚和碳酸氢纳,则仪器B中反应的化学方程式为C6H5ONa+H2O+CO2→ C6H5OH+NaHCO3。
(3)因为醋酸易挥发,所以生成的CO2气体中含有醋酸,醋酸也能和苯酚钠反应生成苯酚,因此实验设计不严密。要改正只需要在A、B之间连接洗气装置,洗气液为饱和NaHCO3溶液,吸收挥发的醋酸即可。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列物质与反应的分类正确的是
A.纯碱、醋酸钠分别属于碱和盐
B.Na、Na2O2与水的反应均是置换反应
C.氯水和次氯酸都属于弱电解质
D.铝与强酸、强碱的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是人体必需的微量元素,含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为_____。
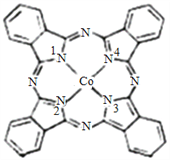
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。
①酞菁钴中三种非金属原子的电负性有大到小的顺序为_________ (用相应的元素符号作答);碳原子的杂化轨道类型为__________;
②与钴离子通过配位键结合的氮原子的编号是_____________。
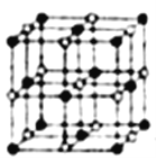
(3)Co的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的氧原子有______个;已知在该钴的氧化物晶体中钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,则在该钴的氧化物晶体中原子的空间利用率为____(用含a、b的式子表示)。
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图中,不能描述CoO2的化学组成的是_______。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________;
(2)实验中需加热至恒重的目的是:___________________;
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_____________;
(2)实验中判断沉淀是否完全的方法是_______________________。
方案三:按如图装置进行实验:
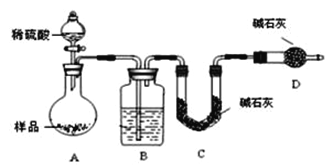
(1)B装置内所盛试剂是_________;D装置的作用是_______;分液漏斗中_______(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为____。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
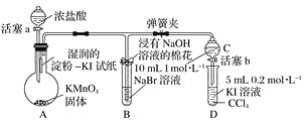
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法
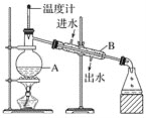
(1)如图是实验室制取蒸馏水的常用装置,图中明显的一个错误是____________________。
(2)仪器A的名称是______________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入几粒____________,其作用是防止液体暴沸。
(4)从锥形瓶取少量收集到的液体于试管中,然后滴入____________和____________(填试剂的化学式),检验是否存在氯离子。
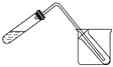
(5)如图装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与上图完全相同。该装置中使用的玻璃导管较长,其作用是______________;烧杯中最好盛有的物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.有氧气参加的反应一定是燃烧
B.燃烧一定要有氧气参加
C.氢气在氯气中燃烧,火焰呈绿色
D.任何发光放热的剧烈的化学反应都可以叫燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
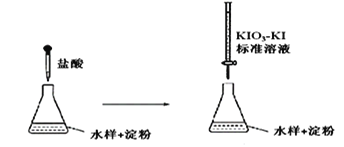
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
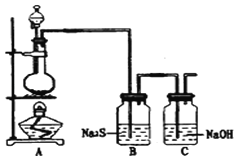
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 均属于盐
B. 焰色反应均为黄色
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com