

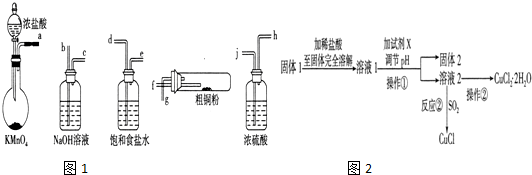
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
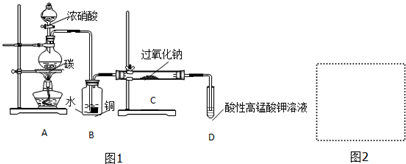
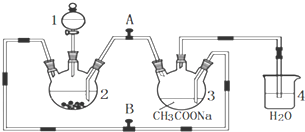
分析 (1)碳与浓硝酸在加热条件下反应生成二氧化碳、二氧化氮和水,据此写出方程式,根据化合价变化标出电子转移的方向和数目;
(2)装置C中需要用NO和过氧化钠反应,则装置B是用于提供NO气体;
(3)通过B装置的气体中含有二氧化碳、NO和水,需要将二氧化碳和水除去,据此选用试剂,并画出装置图;
(4)酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,据此设计实验方案检验装置C中NaNO2的存在;
(5)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,标准液浓度减小;
B.达到过程中锥形瓶不需要干燥,不影响待测液中溶质的物质的量;
C.滴定终了仰视读数,读出的是凹液面下方读数,读数比实际消耗的标准液体积偏大;
D.滴定终了俯视读数,读出的是凹液面上方读数,读数比实际读数偏小;
(6)第一组数据舍弃,计算出其它3组消耗标准液的平均体积,再结合反应方程式计算出样品中亚硝酸钠的质量及质量分数.
解答 解:(1)装置A中C与浓硝酸反应的化学方程式的方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,反应中电子转移数目为4,标出电子转移的方向和数目为: ,
,
故答案为: ;
;
(2)根据实验装置可知,装置C中发生反应:2NO+Na2O2=2NaNO2,则装置B的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO),
故答案为:将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);
(3)为制备纯净NaNO2,需要将进入装置C的气体中的二氧化碳和水除去,碱石灰能够吸收二氧化碳和水,故可以选用碱石灰,装置图如: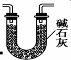 或
或 ,
,
故答案为: 或
或 ;
;
(4)根据题中信息可知,酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+,据此可设计出检验亚硝酸钠的方法为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2,
故答案为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;
(5)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故A正确;
B.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故B错误;
C.滴定终了仰视读数,导致读数偏大,计算出的标准液体积偏大,故C正确;
D.滴定终了俯视读数,滴定管读数偏小,计算出的标准液体积偏小,故D错误;
故答案为:AC;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:$\frac{20.02+20.00+19.98}{3}$mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×$\frac{250mL}{25mL}$=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×$\frac{5}{2}$=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:$\frac{3.45g}{4.000g}$×100%=86.25%,
故答案为:86.25%或0.8625.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度较大,涉及性质实验方案的设计、中和滴定操作及误差分析、氧化还原反应中电子转移的分析、化学计算等知识,明确实验原理及化学实验基本操作方法为解答关键,试题培养了学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 颜色褪成无色 | B. | 浅绿色逐渐加深 | C. | 没有变化 | D. | 变为棕黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
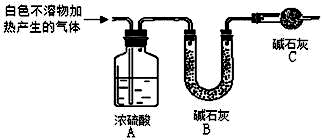
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com