
 .
.
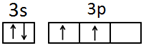
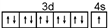
分析 (1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图;
(2)As、Se、Br同属第四周期元素,电离能从左到右逐渐增大,失去第1个电子后,价电子层的P能级上分别是4P2、4P3、4P4,Se处于半充满,第二个电子更难失去,电离能最大;
(3)根据价层电子对互斥理论确定气态SeO3分子的立体构型;根据等电子体要求原子总数相同,价电子数相同来确定;
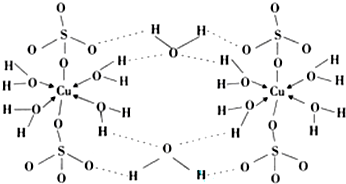
(4)离子之间存在离子键,非金属元素之间形成共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键,氧原子和氢原子间存在氢键;
(5)配合物K2[Cu(CN)4]是离子晶体;在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,2个π键;
(6)利用均摊法计算两种金属原子个数之比,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布 ,
,
故答案为 ;
;
(2)As、Se、Br同属第四周期元素,电离能从左到右逐渐增大,失去第1个电子后,价电子层的P能级上分别是4P2、4P3、4P4,Se处于半充满,第二个电子更难失去,电离能最大,三种元素的第二电离能从小到大的顺序为I2As<I2Br<I2Se,
故答案为:I2As<I2Br<I2Se;
(2)气态SeO3分子中中心原子的价层电子对数为$\frac{6+0}{2}$=3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-,
故答案为:平面三角形;CO32-或NO3-;
(4)铜离子和硫酸根离子之间存在离子键,硫原子和氧原子间存在极性共价键,铜原子和氧原子间存在配位键,氧原子和氢原子间存在氢键,
故答案为:ABDE;
(5)配合物K2[Cu(CN)4]是离子晶体;在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,2个π键,所以1molCN-中含有的π键的数目为2NA,
故答案为:离子晶体;2NA;
(6)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Cu原子与Au原子个数之比=3:1,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=$\frac{m}{V}$=$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-7})^{3}}$g/cm3,
故答案为:3:1;$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-7})^{3}}$.
点评 本题主要考查了价电子排布图、第二电离能、分子空间构型、等电子体、晶胞密度的计算等,解题时要注意对基本知识的灵活运用,第二电离能的判断较难,第(6)题中单位是nm,容易出错,本题综合性强,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
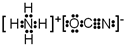 或
或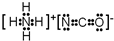 .
. .A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.
.A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.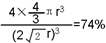 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物XZ2中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢元素能形成原子数目之比为1:1的化合物 | |
| C. | Y的单质与稀硫酸、浓硫酸均可发生氧化还原反应 | |
| D. | Z的单质在加热条件下会与Fe反应生成Fe3Z4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外围电子就是最外层电子 | |
| B. | 最外层电子数小于4的元素一定是金属元素 | |
| C. | 过渡元素的最外层电子数一般为1个或2个 | |
| D. | 如果某元素最外层电子数是1个或2个,次外层电子数为18个,此元素是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;ZX2的化学式是SiO2.
;ZX2的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Cl2 (g) | HCl(g) | 饱和NaCl溶液、浓硫酸 | 洗气 |
| B | Na2CO3(aq) | NaHCO3(aq) | 过量NaOH溶液 | 洗液 |
| C | 铁粉(s) | 铝粉(s) | 过量NaOH溶液 | 过滤 |
| D | FeCl3(aq) | AlCl3(aq) | 过量氨水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com