
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
(1)汽车内燃机工作时发生反应:N
2(g)+O
2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向一体积固定的密闭容器中充入6.5mol N
2和7.5mol O
2,在5min时反应达到平衡状态,测得此时容器中NO的物质的量为5mol.
①反应开始至达到平衡的过程中,容器中下列各项发生变化的是
(填序号).
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N
2和NO的消耗量之比
②在T℃时,该反应的平衡常数K=
;
③假设容器体积为5L,则5min内该反应的平均速率υ(NO)=
;
(2)H
2或CO可以催化还原NO以达到消除污染的目的.
①已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ?mol
-12H
2(g)+O
2(g)═2H
2O(l)△H=-571.6kJ?mol
-1则H
2(g)与NO(g)反应生成N
2(g)和H
2O(l)的热化学方程式是
;判断该反应自发进行的条件:
.
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO
2(g)+N
2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.则该反应的△H
0(填“>”或“<”).若催化剂的表面积S
1>S
2,在该图中画出c(NO)在T
1、S
2条件下达到平衡过程中的变化曲线.

 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务. ;故答案为:<、
;故答案为:<、 .
.


 名校课堂系列答案
名校课堂系列答案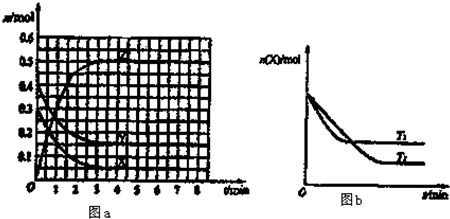
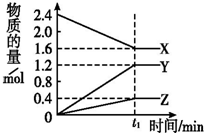 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知: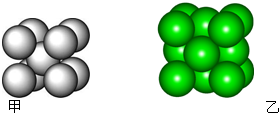 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.