
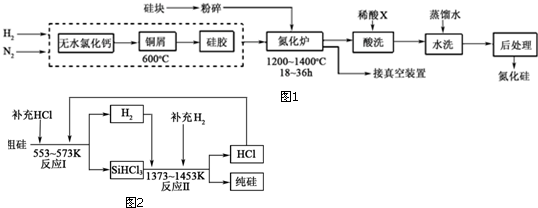
分析 (1)根据信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成;
(2)①Cu能与氧气反应,硅胶具有吸水性;
②控制氮气的流速是防止温度过高,体系中要通入适量的氢气可将氧气转化为水蒸气;
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1.
解答 解:(1)由信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,反应的化学方程式为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
(2)①Cu能与氧气反应,则Cu屑的作用为除去原料气中的氧气;硅胶具有吸水性,可除去生成的水蒸气,
故答案为:除去原料气中的氧气;除去生成的水蒸气;
②氮化炉中3SiO2(s)+2N2(g)=Si3N4(s)△H=-727.5kJ/mol,该反应为放热反应,开始时严格控制氮气的流速以控制温度是防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;体系中要通入适量的氢气是为将体系中的氧气转化为水蒸气,而易被除去(或整个体系中空气排尽),
故答案为:该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽);
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸反应,而氮化硅与硝酸不反应,
故答案为:硝酸;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,反应的化学方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
③反应生产1mol纯硅需补充HCl::$\frac{3}{90%}$-3=$\frac{1}{3}$,需补充H2:$\frac{1}{93.95%}$-1≈0.064,则补充HCl与H2的物质的量之比=$\frac{1}{3}$:0.064≈5:1,
故答案为:5:1.
点评 本题考查制备实验方案的设计,题目难度中等,明确制备实验的装置中各部分的作用及物质的性质是解答本题的关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 | |
| B. | NaCl的电子式: | |
| C. | F+的结构示意图: | |
| D. | Fe3+的最外层电子排布式为3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
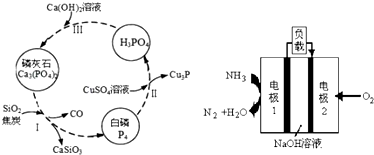
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3固体 | B. | 水 | C. | 硫酸钾固体 | D. | NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸在空气中敞口放置时浓度均减少 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀H2SO4与锌反应时均能产生气体 | |
| D. | H2S、HI气体均不能用浓H2SO4制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水属于化合物 | |
| B. | 一水合氨属于电解质 | |
| C. | 氨气溶于水时,只有极少数氨气与水结合生成一水合氨 | |
| D. | 氨气能使湿润的蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
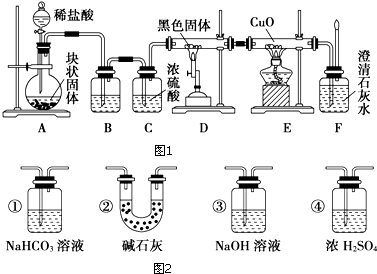
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
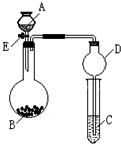 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com