
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
分析 要使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大,通过改变条件使平衡正向移动,但氢离子不能参加反应,据此分析解答.
解答 解:A.加入少量醋酸铵,醋酸根离子浓度增大,抑制醋酸电离,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值减小,故A错误;
B.加入浓的醋酸,醋酸浓度增大,其电离程度减小,醋酸分子浓度增大,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值减小,故B错误;
C.加入少量NaCl固体,醋酸、醋酸根离子及氢离子浓度都不变,不影响平衡移动,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值不变,故C错误;
D.醋酸的电离是吸热反应,升高温度促进醋酸电离,则醋酸电离程度增大,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离影响因素是解本题关键,可以通过改变条件来改变$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值,易错选项是B,注意弱电解质电离程度与其浓度关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
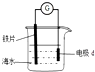
| A. | d为锌块,铁片腐蚀加快 | |
| B. | d为石墨,铁片不易被腐蚀 | |
| C. | d为锌块,铁片上电极反应为:2H++2e-=H2↑ | |
| D. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 氢气可以在氯气中燃烧,说明燃烧反应未必需要氧气参与 | |
| C. | 足量Cl2、S分别和二份等质量的Na反应,两者得到电子一样多 | |
| D. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸根本就不会反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中CO的体积分数相同 | |
| B. | 达到平衡时,甲用时间比乙短 | |
| C. | 甲中CO2的转化率比乙高 | |
| D. | 若甲、乙中都再充入同量的氦气,平衡均不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeC13+Cu=CuC12+2FeC12 | B. | AlCl3+3NH3•H20=Al(0H)3↓+3NH4Cl | ||
| C. | 2Fe(0H)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe203+3H20 | D. | Na2O+CO2=Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2CO3溶液处理水垢中的不溶物:CaSO4(s)+CO${\;}_{3}^{2-}$(aq)=CaCO3(s)+SO${\;}_{4}^{2-}$ | |
| B. | 将Na2S溶液在空气中长期放置变浑浊:2S2-+O2+4H+=2S+2H2O | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-=CaCO3↓+2H2O | |
| D. | 向Fe(NO3)3溶液中通入过量SO2:2Fe3++SO2+2H2O=2Fe2++SO${\;}_{4}^{2-}$+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
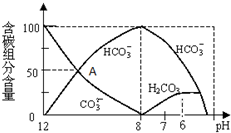
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com