
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:

(1)发生“电解I”时,所用的交换膜是_______________(填“阳离子交换膜”或“阴离子交换膜”)。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为____________________________。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是___。

(3)“电解II”的阳极产物为______________(填离子符号)。
(4)操作a的操作名称是_______,该流程中可循环利用的物质是_____________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为at,最终制得的Cu(ClO4)2·6H2O为bt,则产率为__________(用含a、b的代数式表示)。
【答案】 阳离子交换膜 3Na2CO3+3Cl2![]() 5NaCl+NaC1O3+3CO2 60℃ ClO4- 蒸发浓缩 NaCl (702b/371a)×100%
5NaCl+NaC1O3+3CO2 60℃ ClO4- 蒸发浓缩 NaCl (702b/371a)×100%
【解析】以食盐等为原料制备高氯酸铜[Cu(C1O4)26H2O],则生成产物应生成高氯酸钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气,“歧化反应”时,高氯酸钠与碳酸钠溶液发生歧化反应,生成的产物之一为NaClO3 ,同时生成二氧化碳气体,通电电解,溶液其中氯酸根离子失电子发生氧化反应生成高氯酸根离子,加入盐酸,过滤除去氯化钠晶体,得到60%以上的高氯酸,“反应II”阶段,Cu2(OH)2CO3与HClO4反应经过一系列操作后得到蓝色Cu(ClO4)2溶液。
(1)“电解I”所发生的反应是电解氯化钠溶液生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,需要防止氢氧根离子与氯气反应,因此选择阳离子交换膜,故答案为:阳离子交换膜;
2OH-+H2↑+Cl2↑,需要防止氢氧根离子与氯气反应,因此选择阳离子交换膜,故答案为:阳离子交换膜;
(2)①“歧化反应”时,氯气通入碳酸钠溶液发生反应,生成的产物之一为NaClO3同时生成二氧化碳气体,歧化反应的化学方程式为3Na2CO3+3Cl2![]() 5NaCl+NaC1O3+3CO2,故答案为:3Na2CO3+3Cl2
5NaCl+NaC1O3+3CO2,故答案为:3Na2CO3+3Cl2![]() 5NaCl+NaC1O3+3CO2;
5NaCl+NaC1O3+3CO2;
②图象分析可知60°C产率最高,则该反应最适宜的温度是:60°C,故答案为:60℃;
(3) 通电电解,溶液其中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解II”的阳极产物为ClO4-,故答案为:ClO4-;
(4) 加入盐酸,过滤除去氯化钠晶体,通过蒸发浓缩即可得到60%以上的高氯酸;该流程中可循环利用的物质是NaCl,故答案为:蒸发浓缩;NaCl;
(5)根据流程图,氯化钠电解生成的氯气与碳酸钠反应生成NaC1O3和NaCl,电解后NaC1O3变成NaC1O4,加入盐酸反应生成HC1O4,最后与Cu2(OH)2CO3反应生成Cu(ClO4)2·6H2O
假设起始是氯化钠为6mol,则生成的氯气为3mol,得到1molNaC1O3,根据氯元素守恒最终得到0.5molCu(ClO4)2·6H2O,因此产率=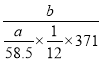 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
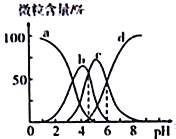
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人的纯净胃液是一种无色而呈酸性的液体,pH在0.9~1.5之间,胃液中含有大量盐酸,其中的H+浓度比血液高几百万倍,试回答下列问题:
①若胃液酸度增高就患胃酸过多症,下列物质不宜用作治疗胃酸过多症药物的主要成分的是(____)
A.小苏打粉 B.氢氧化铝粉 C.氧化钙粉 D.纯碳酸钙粉
②胃溃疡患者胃酸过多可考虑选用①中的 ________________。(填字母编号)写出反应的化学方程式______________________________ 。
(2)现有下列四种物质:A.食盐B.食醋 C.苹果汁 D.葡萄糖,请按下列要求填空(填序号)。
富含维生素C的是_________;可直接进入血液补充能量的是_________;即可作为调味剂,又可预防感冒的是_________;食用过多会引起血压升高、肾脏受损的________。
(3)保护环境、呵护地球已成为为类共同的呼声。
①水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是__________(填字母编号);
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃。根据垃圾分类方法,矿泉水瓶属于__________(填“可回收物”或“可堆肥垃圾”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验: (ⅰ)取三支试管,标记为I、II、III,I中盛有适量蒸馏水,II中盛有适量蒸馏水和植物油,III洁净干燥
(ⅱ)在三支试管中各放入一根无锈铁钉.并将II和III用软木塞塞紧,III中放入一小团棉花(如图所示).请回答:
(1)三支试管中铁钉锈蚀的速度从高到低依次排列为 由此可以得出铁钉锈蚀的条件有和 .
若该同学将I放在每天阳光直晒的阳台上,与避光保存相比,哪种保存方法锈蚀更快?这说明锈蚀速度与什么因素有关?
若该同学将I中的液体换做食盐水,对锈蚀的速率有何影响?这说明锈蚀速率还和什么因素有关? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,并回答下列问题: 
(1)判断装置的名称:A池为 .
(2)锌电极反应式为 , 石墨棒C1为极,电极反应式为 , 石墨棒C2附近发生的实验现象为 .
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了g.CuSO4溶液的质量增加了g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是制备治疗高血压药物纳多洛尔的中间体。实验室由A制备G的一种路线如下:

(1)A的化学名称是_____________________________。
(2)H中所含官能团的名称是____________________;由G生成H的反应类型是_________。
(3)C的结构简式为______________,F的结构简式为_________________。
(4)由D生成E的化学方程式为_______________________________。
(5)芳香族化合物X是F的同分异构体,1molX最多可与4molNaOH反应,其核磁共振氯谱显示分子中有3种不同化学环境的氢,且峰面积比为3:3:1。写出两种符合要求的X的结构简式:_______________。
(6)写出以甲苯和(CH3CO)2O为原料(其他无机试剂任选)制备化合物![]() 的合成路线:_______________________________________________________。
的合成路线:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的C02、N2.电池工作时,下列说法错误的是( )

A. 负极发生的反应为:![]()
B. 正极附近溶液的pH增大
C. 隔膜只允许阳离子通过
D. 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液,②乙醇和丁醇,③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式如图,关于该有机物,下列叙述不正确的是( )
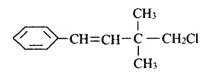
A. 能使酸性KMnO4溶液、溴水褪色,原理相同
B. 1 mol该有机物能与H2发生反应,消耗H2物质的量为4mol
C. 一定条件下,能发生加聚反应
D. 该有机物苯环上的一个H被取代,有3种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com